题目内容
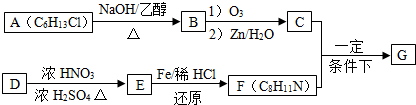
17.某芳香烃A有如图转化关系:
(1)写出反应②和⑤的反应条件:②氢氧化钠水溶、加热;⑤浓硫酸、加热.
(2)写出A的结构简式:
 ;
;(3)写出反应④的化学方程式:
 .
.(4)反应③的反应类型氧化反应.
(5)根据已学知识和获取的信息,写出以CH3COOH,
 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)合成路线流程图示例如下:
CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$

 .
.
分析 由反应④可知D为 ,则C为
,则C为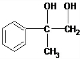 ,故A为
,故A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为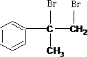 ,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为
,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为 ,则E与甲醇发生酯化反应生成F,故E为
,则E与甲醇发生酯化反应生成F,故E为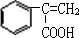 ,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,据此解答.
,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,据此解答.
解答 解:由反应④可知D为 ,则C为
,则C为 ,故A为
,故A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为 ,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为
,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为 ,则E与甲醇发生酯化反应生成F,故E为
,则E与甲醇发生酯化反应生成F,故E为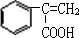 ,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,
,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,
(1)反应②是卤代烃在氢氧化钠水溶、加热条件下发生水解反应,反应⑤是醇在浓硫酸、加热条件下发生消去反应,故答案为:氢氧化钠水溶、加热;浓硫酸、加热;
(2)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(3)反应④的化学方程式: ,
,
故答案为: ;
;
(4)反应③是 发生催化氧化生成
发生催化氧化生成 ,故答案为:氧化反应;
,故答案为:氧化反应;
(5)以CH3COOH, 为原料合成重要的化工产品
为原料合成重要的化工产品 ,应先制备
,应先制备 ,可由
,可由 经消去、加成、水解后生成,则合成的流程为:
经消去、加成、水解后生成,则合成的流程为: ,
,
故答案为:
点评 本题考查有机物的推断与合成,注意根据D的氧化产物结构以及F的加聚产物结构,结合反应条件进行推断,需要学生熟练掌握官能团的性质,题目难度中等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
7.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定、易分解,CuH在氯气中能燃烧,跟盐酸反应能产生气体,以下有关它的推断中错误的是( )
| A. | “另一种反应物”一定具有还原性 | B. | “另一种反应物”一定只具有氧化性 | ||
| C. | 2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | D. | CuH既可作氧化剂也可作还原剂 |
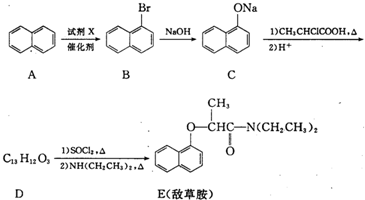
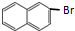 ,试剂X是液溴.
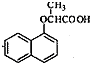
,试剂X是液溴.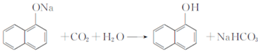 .
. ,由D到E的过程中发生的化学反应类为取代反应.
,由D到E的过程中发生的化学反应类为取代反应.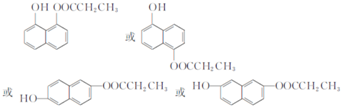 .
.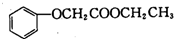 的合成路线图(无机试剂任用).合成路线图示例:
的合成路线图(无机试剂任用).合成路线图示例:
 .
. (填结构简式).
(填结构简式).






 .
.


 .
.