题目内容
2.(1)现有如下A、B两反应:A:2NaOH+H2SO4=Na2SO4+2H2O,B:Zn+H2SO4=ZnSO4+H2↑;
则A、B反应能设计成为原电池的是A(填“A”或“B”).
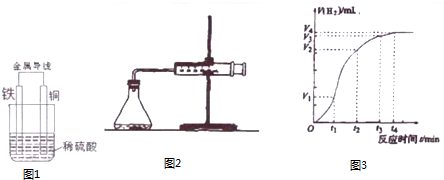
(2)某原电池示意图如图1,则该电池负极电极的反应方程式为Fe-2e-=Fe2+.
(3)若该电池反应过程中共有0.3mol电子发生转移,则生成的H2在标准状况下的体积是3.36L.
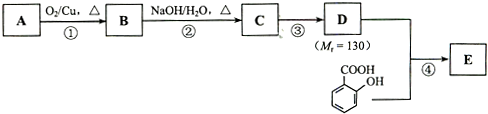
(4)为了研究Fe与稀H2SO4反应的速率,某同学通过如图2实验装置测定反应中生成的H2体积,绘制了如图3所示的曲线,在该实验过程中发现锥形瓶温度升高.请回答以下问题.
在0~t1、t1~t2、t2~t3各个时间段里,反应速率最大的时间段是t1~t2,产生这种情况可能的原因是该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快;该实验过程中收集到气体最多的是在t1~t2时间内.
(5)为了减缓该反应的速率,你认为可行的方法是AC.
A.向H2SO4溶液中加蒸馏水 B.将Fe片改成Fe粉
C.向H2SO4溶液中加Na2SO4溶液 D.向H2SO4溶液中滴入几滴CuSO4溶液.
分析 (1)原电池反应必须是自发进行的放热的氧化还原反应;
(2)Cu、Fe、硫酸构成的原电池,活泼金属铁是负极,发生失电子的氧化反应,据此回答;
(3)根据原电池的正极反应式来计算回答;
(4)根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大;温度越高,反应速率越快;收集到的气体最多的是体积之差最大的;
(5)降低反应速率,可以通过减小溶液中氢离子浓度实现.
解答 解:(1)原电池反应必须是自发进行的放热的氧化还原反应,Zn+H2SO4=ZnSO4+H2↑符合,但是A不是氧化还原反应,故选:A;
(2)Cu、Fe、硫酸构成的原电池,活泼金属铁是负极,发生失电子的氧化反应:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)根据原电池的正极反应式H++2e-=H2↑,过程中共有0.3mol电子发生转移,则生成的H2式0.15mol,标准状况下的体积是3.36L,故答案为:3.36L.
(4)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知,斜率最大的是t1~t2,反应的化学反应速率最快,该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快,收集到的气体最多的是体积之差最大的,即产生气体体积最大的是t1~t2时间段,
故答案为:t1~t2;该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快;t1~t2;
(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,故选AC.
点评 本题考查了化学反应速率的影响因素、根据方程式进行计算,知道浓度、温度对化学反应速率任何改变,再结合速率的影响因素分析解答,知道斜率与速率的关系,题目难度不大.

| A. | 单质的氧化性逐渐减弱 | B. | 单质的熔、沸点逐渐降低 | ||
| C. | 单质的密度逐渐降低 | D. | 气态氢化物的稳定性逐渐增强 |
| A. | 常温下,苯酚易溶于水 | |
| B. | 苯酚俗称石炭酸,具有微弱的酸性,能与碳酸钠溶液反应 | |
| C. | 纯净的苯酚是粉红色晶体 | |
| D. | 洒落皮肤上的苯酚可以用氢氧化钠稀溶液洗涤 |
| A. | 锂 | B. | 钠 | C. | 氟 | D. | 氯 |
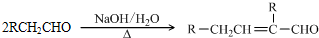
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.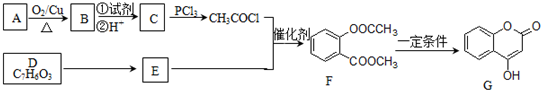


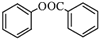 )的合成路线流程图(无机原料任用).
)的合成路线流程图(无机原料任用).
 ;
;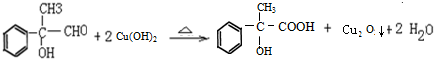 .
.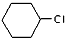 为原料合成重要的化工产品
为原料合成重要的化工产品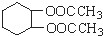 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)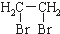
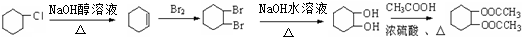 .
.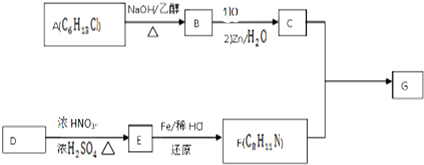
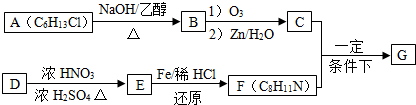
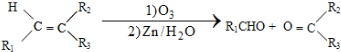
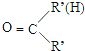 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O.
+H2O. .
. .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$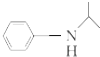
 .
.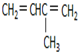 2-甲基-1,3-丁二烯;
2-甲基-1,3-丁二烯;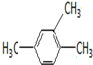 1,2,4-三甲基苯;
1,2,4-三甲基苯;