题目内容
12.0.5molO2中含有的氧分子的数目是多少?质子数目是多少?分析 根据N=nNA计算O2分子数目,每个O2分子含有16个质子,质子数目为O2分子的16倍.
解答 解:0.5molO2中含有的氧分子的数目是0.5mol×6.02×1023mol-1=3.01×1023,
每个O2分子含有16个质子,含有的质子数目为16×3.01×1023,
答:含有氧分子的数目是3.01×1023,含有的质子数目为16×3.01×1023.
点评 本题考查物质的量有关计算,侧重考查微粒数目计算,注意掌握以物质的量为中心的计算,理解掌握物质的组成.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
2.下列判断正确的是( )
| A. | 沸点:CH4>NH3>H2O | B. | 得电子能力:C>N>O | ||
| C. | 酸性:H2SO4>HClO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
3.下列各组物质中,一定互为同系物的是( )
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. |  和 和  | D. | HCHO、CH3COOH |
20.下列说法中,正确的是( )
| A. | 化学键是原子间的相互作用 | |
| B. | 离子键是阴阳离子间的静电吸引 | |
| C. | 化学键被破坏的变化一定是化学变化 | |
| D. | 共价化合物中一定不含离子键 |
7.一定条件下,密闭容器发生反应2SO2(g)+O2(g)?2SO3(g),生成2molSO3(g)时,放出QkJ热量,下列说法正确的是( )
| A. | 相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量 | |
| B. | 当v(正)>v(逆)时,随着反应进行,反应物的物质的量减少 | |
| C. | 相同条件下,若用18O2与SO2(g)在密闭容器中反应,达平衡时,18O存在于二氧化硫、氧气、三氧化硫中 | |
| D. | 相同条件下,向密闭容器中加入2molSO2(g)和1molO2(g)充分反应后,放出的热量为QkJ |
17.随着卤族元素原子序数递增,下列说法正确的是( )
| A. | 单质的氧化性逐渐减弱 | B. | 单质的熔、沸点逐渐降低 | ||
| C. | 单质的密度逐渐降低 | D. | 气态氢化物的稳定性逐渐增强 |
4.燃料电池的基本组成为电极、电解质、燃料和氧化剂.此种电池的能量利用率可高达80%,产物污染也少.下列有关燃料电池说法错误的是( )
| A. | 氢氧燃料电池的电解质用KOH溶液时,其负极电极反应为2H2-4e-+4OH-═4H2O | |
| B. | 燃料电池负极燃料失电子,发生还原反应 | |
| C. | 碱性甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- | |
| D. | 除纯氧外,空气中的氧气也可以作氧化剂 |

 ;
;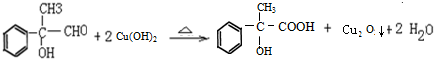 .
.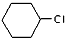 为原料合成重要的化工产品
为原料合成重要的化工产品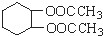 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)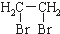
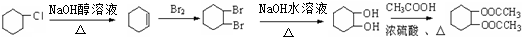 .
.