题目内容
7.汽车尾气和燃煤造成空气污染.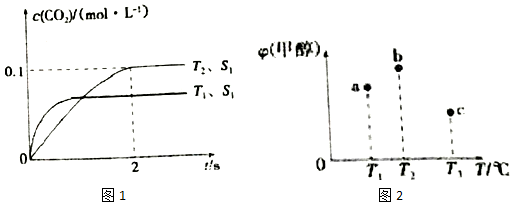
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
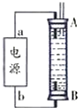
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
分析 (1)①根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比列式;
②向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,计算此时的浓度商Qc,与830℃时的K做比较可得反应进行的方向;
③根据化学平衡时正逆反应速率相等,各组分含量保持不变分析选项;
(2)①由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(3)①a.根据升高温度平衡移动的方向判断反应热;
b.未到达平衡前,升高温度甲醇的含量增大,到达平衡后再升高温度,平衡向逆反应方向移动,甲醇的含量降低,而5min时,b容器中甲醇的含量不一定最高,不一定是平衡状态;
c.b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,根据方程式的特点,升高温度或减压都可以;
d.根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算CO反应的物质的量,根据CO反应的物质的量计算其转化率.
解答 解:(1)①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的化学平衡常数K=$\frac{C(C{H}_{3}OC{H}_{3}){c}^{2}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OC{H}_{3}){c}^{2}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
②向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,列三段式:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
c始:1 0.7 0 0
c转:0.2 0.6 0.1 0.3
c(某时刻):0.8 0.1 0.1 0.3
由图表可知830℃时的K=1,则此时的浓度商Qc=$\frac{0.{3}^{3}×0.1}{0.{8}^{2}×0.{1}^{6}}$>1,故此时反应向着逆方向进行,V (正)<V (逆);
故答案为:<;
②A.混合气体的总质量不变,恒容混合气体的体积不变,容器中密度始终不变,故A错误;
B.反应的气体数目发生改变,恒容则压强改变,平衡时,压强保持不变,故B正确;
C.混合气体的总质量不变,混合气体的总的物质的量变小,平均摩尔质量变大,平衡时,保持不变,故C正确;
D.v(CO2):v(H2)=1:3,未说明正逆方向,故D错误;
E.单位时间内消耗2mol CO2,说明生成1mol二甲醚,同时消耗1mol二甲醚,说明二甲醚的含量保持不变,化学平衡,故E正确;
F.反应△H不变,故F错误;
故答案为:BCE;
(2)①由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$=0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L•s)=0.025mol/(L•s);
故答案为:0.025mol/(L•s);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: ;
;
故答案为: ;
;
(3)①a.升高温度,甲醇的百分含量减小,说明正反应是放热反应,则△H<0,故a错误;
b.5min时,b容器中甲醇的含量不一定最高,不一定是平衡状态,则v(正)、v(逆)那样的相等,故b错误;
c.b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,反应物的化学计量数之和大于生成物的,应是减小压强平衡逆向移动,故c正确;
d.达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c,故d错误;
故答案为:c;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率为$\frac{0.45}{1}×100%$=45%;
故答案为:45%.
点评 本题考查盖斯定律、化学平衡移动和物质的量计算,难度中等,其中热化学方程式书写,和焓变的计算,并能分析化学平衡中转化率曲线的变化,掌握基础是解题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 水 碱石灰 | B. | 金刚石 干冰 | C. | 液氧 氯酸钾 | D. | 汞 纯碱 |
 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,(1)如图所示的物质分类方法名称是树状分类法.
(2)
| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
| A. | 3S+6NaOH═Na2SO3+2Na2S+3H2O | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | 2FeCl2+Cl2=3FeCl3 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
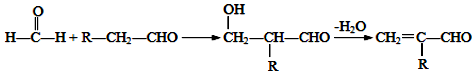
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).

 .
. (写出一种即可).
(写出一种即可). .
.