题目内容
2.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)(1)写出F原子的外围电子排布式3d64s2.
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)F和M(质子数为25)两元素的部分电离能数据列于右表:比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是:Mn2+的3d轨道电子排布为半满状态较稳定.
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(5)如图a、b分别为M、F晶体的堆积模型,假设M的原子半径分别为Ranm,它的空间利用率:(不用化简)M$\frac{π}{3\sqrt{2}}$.

分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大,其中A、C原子的L层有2个未成对电子,且A原子序数小于C,则A是C、C是O元素,B介于A和C元素之间,为N元素;
D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素;E为Ca元素,
F3+离子M层3d轨道电子为半满状态,F原子核外电子数为26,为Fe元素;
(1)Fe原子核外3d、4s能级电子为其价电子,根据构造原理书写Fe原子价电子排布式;
(2)原子个数相等、电子数相等的微粒互为等电子体;C22-中成键原子价层电子对个数是2,根据价层电子对互斥理论判断C原子杂化方式;
(3)F是Fe元素、M是Mn元素,原子轨道电子数处于全满、全空、半满时最稳定;
(4)含有氢键的氢化物熔沸点较高、溶解性较大;
(5)b中M原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子所占体积=4×$\frac{4}{3}$πRa3(nm)3,晶胞中面上3个原子共直线,则棱长=2$\sqrt{2}$Ranm,晶胞体积=(2$\sqrt{2}$Ra)3(nm)3.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大,其中A、C原子的L层有2个未成对电子,且A原子序数小于C,则A是C、C是O元素,B介于A和C元素之间,为N元素;
D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素;E为Ca元素,
F3+离子M层3d轨道电子为半满状态,F原子核外电子数为26,为Fe元素;
(1)Fe原子核外3d、4s能级电子为其价电子,根据构造原理书写Fe原子价电子排布式为3d64s2,
故答案为:3d64s2;
(2)原子个数相等、电子数相等的微粒互为等电子体,则与A22-互为等电子体的单质是N2;C22-中成键原子价层电子对个数是2,根据价层电子对互斥理论判断C原子杂化方式为sp,
故答案为:N2;sp;
(3)F是Fe元素、M是Mn元素,原子轨道电子数处于全满、全空、半满时最稳定,Mn2+的3d轨道电子排布为半满状态较稳定,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;
(4)含有氢键的氢化物熔沸点较高、溶解性较大,H2O2分子间存在氢键,与水分子可形成氢键,所以双氧水的熔沸点和溶解性大于硫化氢,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(5)b中M原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子所占体积=4×$\frac{4}{3}$π(Ra)3(nm)3,晶胞中面上3个原子共直线,则棱长=2$\sqrt{2}$Ranm,晶胞体积=(2$\sqrt{2}$Ra)3(nm)3,其空间利用率=$\frac{4×\frac{4}{3}π(Ra)^{3}(nm)^{3}}{(2\sqrt{2}Ra)^{3}(nm)^{3}}$=$\frac{π}{3\sqrt{2}}$,
故答案为:$\frac{π}{3\sqrt{2}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、氢键、等电子体、原子杂化方式判断等知识点,侧重考查学生分析、判断及计算能力,难点是晶胞计算,注意(5)中每个面上对角线的3个原子紧邻,题目难度中等.

 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
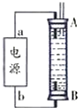
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
(1)则反应:SO2(g)+Cl2(g)+SO2?Cl2(l)△H=(-a-b)kJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$
(2)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.
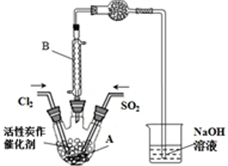
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g),设计制备磺酰氯的装置如图,有关信息如表所示.
| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
②若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择B;实验结束后,将A中混合物分离开的最好方法是G.
A.常温 B.冰水浴 C.加热至69.1℃D.沸水浴
E.过滤 F.萃取 G.蒸馏 H.重结晶
④分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写SO2Cl2与NaOH溶液反应的化学方程式SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O
⑤若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的比例模型 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | H2与H+互为同位素 |
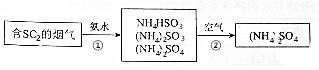 燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.
燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.请回答:
(1)含SO2的烟气未经处理直接排放的危害是ab(填字母).
a.危害人体健康 b.影响动植物生长
(2)SO2跟氨水反应生成NH4HSO3的化学方程式是SO2+NH3+H2O=NH4HSO3.
(3)②中通入空气发生反应时,NH4HSO3是b(填字母)
a.氧化剂 b.还原剂
(4)某研究小组对①产生的溶液进行监测,测得有关数据如下:
| 离子 | NH4+ | SO32- | HSO3- | SO42- |
| 浓度(mol/L) | 1.22 | 0.55 | 0.02 |

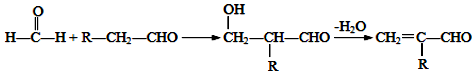
 .
.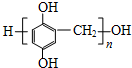 (写出一种即可).
(写出一种即可).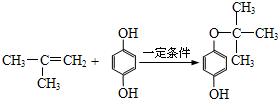 .
.