题目内容
14.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如图: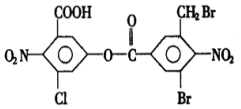
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
已知:RCH2COONa+NaOH(CaO)$\stackrel{△}{→}$RCH3+Na2CO3.
| A. | 5mol,10mol | B. | 6mol,2mol | C. | 8mol,4mol | D. | 8mol,2mol |
分析 由结构可知,分子中含-COOH、-COOC-、-Cl、-Br均与NaOH反应,且水解生成的酚-OH与NaOH反应,生成的有机物中共有2个-COONa,可与氢氧化钠反应生成碳酸钠,以此来解答.
解答 解:由结构可知,分子中含-COOH、-COOC-、-Cl、-Br均与NaOH反应,且水解生成的酚-OH与NaOH反应,
则1mol该化合物中-COOH、-COOC-、-Cl、-Br消耗NaOH为5mol,水解生成的3mol酚-OH又消耗NaOH3mol,则充分反应后最多可消耗氢氧化钠的物质的量为8mol,生成的有机物中共有2个-COONa,由题给信息可知,液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为2mol.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.

练习册系列答案
相关题目
5.氢气还原氧化亚铁:FeO+H2$\frac{\underline{\;\;△\;\;}}{\;}$ H2O+Fe,在该反应中( )
| A. | Fe做还原剂 | B. | FeO做氧化剂 | ||
| C. | 铁元素的化合价降低 | D. | 铁元素化合剂升高 |
2. 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,
(1)如图所示的物质分类方法名称是树状分类法.
(2)
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中①②③⑥⑧⑨⑩后面的横线上.
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,(1)如图所示的物质分类方法名称是树状分类法.
(2)
| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
9.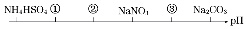 相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
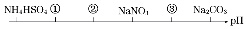 相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )| A. | NH4Cl、(NH4)2SO4、CH3COONa | B. | (NH4)2SO4、NH4Cl、CH3COONa | ||
| C. | (NH4)2SO4、NH4Cl、NaOH | D. | CH3COONa、NH4Cl、(NH4)2SO4 |
6.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 它可能能使酸性高锰酸钾溶液褪色 | |
| B. | 一氯代物可能只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
3.已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( )


| A. | 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
17. 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
(1)则反应:SO2(g)+Cl2(g)+SO2?Cl2(l)△H=(-a-b)kJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$
(2)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.
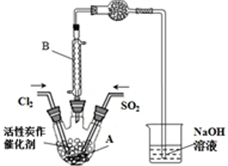
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g),设计制备磺酰氯的装置如图,有关信息如表所示.
①B仪器在本实验中的作用是冷凝SO2Cl2(或使挥发的产物SO2Cl2冷凝);由此可见该反应为放(填“吸”或“放”)热反应,干燥管的作用是防止水蒸气进入A与SO2Cl2发生水解反应,吸收SO2和Cl2气体,防止污染空气
②若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择B;实验结束后,将A中混合物分离开的最好方法是G.
A.常温 B.冰水浴 C.加热至69.1℃D.沸水浴
E.过滤 F.萃取 G.蒸馏 H.重结晶
④分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写SO2Cl2与NaOH溶液反应的化学方程式SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O
⑤若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).
 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
(1)则反应:SO2(g)+Cl2(g)+SO2?Cl2(l)△H=(-a-b)kJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$
(2)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g),设计制备磺酰氯的装置如图,有关信息如表所示.
| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
②若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择B;实验结束后,将A中混合物分离开的最好方法是G.
A.常温 B.冰水浴 C.加热至69.1℃D.沸水浴
E.过滤 F.萃取 G.蒸馏 H.重结晶
④分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写SO2Cl2与NaOH溶液反应的化学方程式SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O
⑤若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).

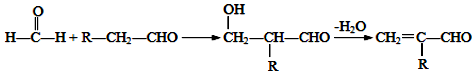
 .
.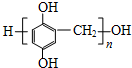 (写出一种即可).
(写出一种即可).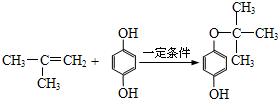 .
.