题目内容
16.在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
②若将1mol N2和3mol H2放入一密闭容器中在催化剂存在下进行反应,理论上放出或吸收的热量为Q1,而在实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是A.
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2.
分析 ①化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式以及反应物、生成物的键能计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
②合成氨是可逆反应,反应物不能完全转化为生成物.
解答 解:①在反应N2+3H2?2NH3中,断裂1mol N三N键、3mol H-H键共吸收的能量为:946kJ+3×436kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:吸收;2254;释放;2346; 放热;
②Q1的数值是按完全转化计算出来的,而合成氨是可逆反应,开始时加入的1 mol N2和3 mol H2不能完全反应生成2 mol NH3,所以Q1>Q2,
故答案为:A.
点评 本题考查了键能与反应热的关系,形成化学键放出能量,破坏化学键吸收能量,反应热=形成化学键放出能量-破坏化学键吸收能量,注意相关基础知识的积累,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②苯 ③酒精( )
| A. | 只有① | B. | ①和② | C. | ①和③ | D. | ①②③ |
11.合成氨原料气H2可通过CO和水蒸气在一定条件下反应制得.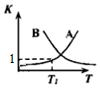
(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
①T2、T3、T4的大小关系为T2<T3<T4,判断的理由是该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4.
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.

(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.
5.用于制造隐形飞机的某种物质结构为: 则该物质属于( )
则该物质属于( )
 则该物质属于( )
则该物质属于( )| A. | 烯烃 | B. | 无机物 | C. | 有机物 | D. | 烷烃 |
6.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )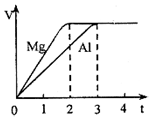

| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |