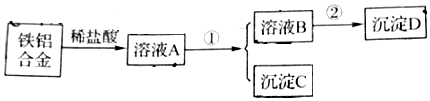
题目内容
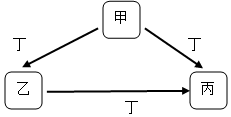
8.甲与乙在溶液中的转化关系如图所示(反应条件省略),甲不可能是( )
| A. | NH3 | B. | AlO2- | C. | CO32- | D. | CH3COO- |
分析 A、氨气与二氧化碳反应生成碳酸铵或碳酸氢铵,碳酸铵或碳酸氢铵与碱反应生成氨气;
B、偏铝酸盐与二氧化碳反应生成氢氧化铝,氢氧化铝与碱反应生成偏铝酸盐;
C、碳酸酸盐与二氧化碳反应生成碳酸氢盐,碳酸氢盐与碱反应生成碳酸盐;
D、醋酸根离子与二氧化碳不反应.
解答 解:A、氨气与二氧化碳反应生成碳酸铵或碳酸氢铵,碳酸铵或碳酸氢铵与碱反应生成氨气,能实现甲与乙之间的转化,故A正确;
B、偏铝酸盐与二氧化碳反应生成氢氧化铝,氢氧化铝与碱反应生成偏铝酸盐,能实现甲与乙之间的转化,故B正确;
C、碳酸酸盐与二氧化碳反应生成碳酸氢盐,碳酸氢盐与碱反应生成碳酸盐,能实现甲与乙之间的转化,故C正确;
D、醋酸的酸性强碳酸,则醋酸根离子与二氧化碳不反应,不能实现甲与乙之间的转化,故D错误;
故选D.
点评 本题考查无机物的推断,属于验证型题目,把握物质的性质及图中转化关系为解答的关键,注意微粒之间发生的反应,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
18.常用做食品包装材料的是( )
| A. | 聚氯乙烯 | B. | 聚苯乙烯 | C. | 酚醛树脂 | D. | 聚乙烯 |
3.下列说法中不正确的是( )
| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 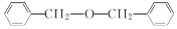 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 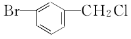 属于芳香卤代烃 属于芳香卤代烃 |
13.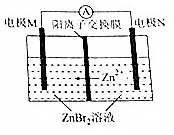 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )| A. | 放电时,电极N为正极 | |
| B. | 放电时.正极的电极反应式为Br2+2e-═2B- | |
| C. | 充电时,电极M与直流电源的负极相连 | |
| D. | 充电时,Zn2+通过离子交换膜从右向左迁移 |
7.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).