题目内容
4.用Fe、Al合金废料制取Al(OH)3与Fe(OH)3.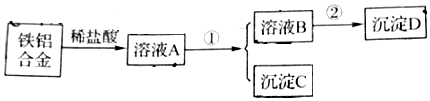
(1)沉淀C为Fe(OH)3,沉淀D为Al(OH)3.
(2)步骤①加入的试剂应为NaOH溶液,步骤①的现象是生成红褐色沉淀.
(3)步骤②加入的试剂最合适的是CO2,发生的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 Fe、Al加入稀盐酸,可生成氯化铝、氯化铁,得到溶液A,然后加入过量的NaOH溶液得到沉淀C为Fe(OH)3,溶液B为NaAlO2,②应为二氧化碳,沉淀D为Al(OH)3,以此解答该题.
解答 解:(1)由以上分析可知C为Fe(OH)3,D为Al(OH)3,故答案为:Fe(OH)3;Al(OH)3;
(2)步骤①用于分离氯化铁、氯化铝,应为NaOH溶液,现象时生成红褐色沉淀,故答案为:NaOH溶液;生成红褐色沉淀;
(3)由于氢氧化铝溶于强酸,则②应为二氧化碳,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查物质制备,为高频考点,侧重考查学生的分析能力和实验能力,明确化学反应原理及物质性质、基本操作是解本题关键,知道流程图中可能存在的反应及基本操作方法,知道每一种物质的成分,题目难度中等.

练习册系列答案
相关题目
8.甲与乙在溶液中的转化关系如图所示(反应条件省略),甲不可能是( )


| A. | NH3 | B. | AlO2- | C. | CO32- | D. | CH3COO- |
12.下列实验操作或说法正确的是( )


| A. | 用玻璃棒蘸取CH3COOH溶液点在用水湿润的pH试纸上,测定该溶液的pH | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用如图装置乙加热分解NaHCO3固体 |
19.下列关于同温同压下的两种气体CH4和O2的判断正确的是( )
| A. | 体积相等时密度之比为2:1 | |
| B. | 原子数相等时具有的电子数之比为1:4 | |
| C. | 质量相等时具有的质子数之比为4:5 | |
| D. | 体积相等时具有的原子数之比为1:2 |
9.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω2 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ3 |
| A. | 2c1<1.5 | |
| B. | ρ1=ρ3 | |
| C. | ω2=2ω3 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3c-1.5)^{3}}$ |
16.有机物C5H11OH为饱和一元醇,其可能的结构共有( )
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
13.下列关于有机物因果关系的叙述中,完全正确的一组是( )
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
14.实验是研究化学的基础,下列有关实验的方法、装置或操作不正确的是( )
| A. |  从氯化钠溶液中得到氯化钠晶体,可使用如图甲所示实验装置 | |
| B. |  分离石油,得到汽油、煤油和柴油等各种馏分,可使用如图乙所示实验装置 | |
| C. |  实验室制氨气,实验装置如图丙所示 | |
| D. |  分离乙醇和乙酸的混合液,实验装置如图丁所示 |