题目内容
13.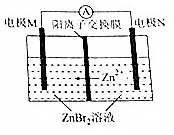 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )| A. | 放电时,电极N为正极 | |
| B. | 放电时.正极的电极反应式为Br2+2e-═2B- | |
| C. | 充电时,电极M与直流电源的负极相连 | |
| D. | 充电时,Zn2+通过离子交换膜从右向左迁移 |
分析 充电时,该装置是电解池,阳极上失电子发生氧化反应;放电时,该装置是原电池,负极上失电子发生氧化反应,据此分析.
解答 解:A、放电时,是原电池,原电池阳离子向正极移动,所以N为负极,故A错误;
B、正极发生还原反应,正极的电极反应式为Br2+2e-═2Br-,故B正确;
C、充电时,电极M与直流电源的正极相连,而不是负极相连,故C错误;
D、充电时,是电解池,阳离子向阴极移动,Zn2+通过离子交换膜从左向右迁移,故D错误;
故选B.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
相关题目
3.下列式子是某学生书写的C5H12的同分异构体的结构简式
①CH3CH2CH2CH2CH3
②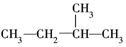
③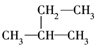
④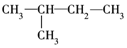
⑤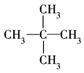
这些结构中出现重复的是( )
①CH3CH2CH2CH2CH3
②
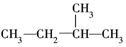
③

④
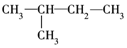
⑤

这些结构中出现重复的是( )
| A. | ②和③ | B. | ④和⑤ | C. | ③和⑤ | D. | 均不重复 |
4.现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②乙醇水溶液 ③氯化钠和单质溴的水溶液 ④碳酸钙和氯化钙溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏、蒸发 | B. | 萃取、蒸馏、分液、过滤 | ||
| C. | 分液、蒸馏、萃取、过滤 | D. | 蒸馏、萃取、分液、过滤 |
1.一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+2Y(g)?3Z(g)+W(s),10min后达到平衡,此时生成3amolZ.下列说法正确的是( )
| A. | 用X表示此反应的反应速率时是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到了平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v正增大,v逆减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
8.甲与乙在溶液中的转化关系如图所示(反应条件省略),甲不可能是( )


| A. | NH3 | B. | AlO2- | C. | CO32- | D. | CH3COO- |
12.下列实验操作或说法正确的是( )


| A. | 用玻璃棒蘸取CH3COOH溶液点在用水湿润的pH试纸上,测定该溶液的pH | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用如图装置乙加热分解NaHCO3固体 |
9.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω2 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ3 |
| A. | 2c1<1.5 | |
| B. | ρ1=ρ3 | |
| C. | ω2=2ω3 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3c-1.5)^{3}}$ |
10.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为吸热反应(选填“吸热”、“放热”).
(2)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(3)若 830℃时,向1L密闭容器中充入1mol CO、1mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”),平衡时,CO的浓度是0.5mol/L
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向 (选填“正反应方向”、“逆反应方向”、“不移动”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(选填“吸热”、“放热”).
(2)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(3)若 830℃时,向1L密闭容器中充入1mol CO、1mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”),平衡时,CO的浓度是0.5mol/L
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向 (选填“正反应方向”、“逆反应方向”、“不移动”)