题目内容
19.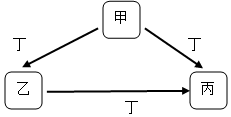 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).(1)若丁为KOH溶液,写出乙的一种用途医用胃酸中和剂,甲→丙的离子方程式为Al3++4OH-═AlO2-+2H2O.
(2)若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:Fe(NO3)2+2NaOH═Fe(OH)2↓+2NaNO3;4Fe(OH)2+O2+2H2O═4Fe(OH)3;该实验现象为生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色.
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为CO2(SO2也可).
分析 (1)若丁为KOH溶液,甲可为氯化铝,乙为氢氧化铝,丙为偏铝酸钠;
(2)若丁为Fe,甲可为硝酸,乙为硝酸铁,丙为硝酸亚铁;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,甲可为NaOH,丁可为CO2,乙为碳酸钠,丙为碳酸氢钠,如丁为SO2,乙为亚硫酸钠,丙为亚硫酸氢钠,以此解答该题.
解答 解:(1)若丁为KOH溶液,甲可为氯化铝,乙为氢氧化铝,丙为偏铝酸钠,氢氧化铝可用于医用胃酸中和剂,氯化铝与过量氢氧化钠反应生成偏铝酸钠,离子方程式为Al3++4OH-═AlO2-+2H2O,
故答案为:医用胃酸中和剂;Al3++4OH-═AlO2-+2H2O;
(2)若丁为Fe,甲可为硝酸,乙为硝酸铁,丙为硝酸亚铁,向丙溶液中加入NaOH溶液的化学方程式为Fe(NO3)2+2NaOH═Fe(OH)2↓+2NaNO3;4Fe(OH)2+O2+2H2O═4Fe(OH)3,可观察到生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:Fe(NO3)2+2NaOH═Fe(OH)2↓+2NaNO3;4Fe(OH)2+O2+2H2O═4Fe(OH)3;生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,甲可为NaOH,丁可为CO2,乙为碳酸钠,丙为碳酸氢钠,如丁为SO2,乙为亚硫酸钠,丙为亚硫酸氢钠,
故答案为:CO2(SO2也可).
点评 本题考查了物质间的转化,为高频考点,侧重考查学生的分析能力,明确物质的性质是解本题关键,根据反应特点知“甲生成丙还是先生成乙再转化为丙”,与丁的量有关,再结合物质的性质分析解答即可,难度较大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 某溶液加入足量硝酸银溶液产生白色沉淀,证明其中一定存在Cl- | |
| B. | 某溶液加入足量稀盐酸无现象,再加入BaCl2产生白色沉淀,证明其中一定存在SO42- | |
| C. | 某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,证明其中一定存在CO32- | |
| D. | 向品红溶液中通入某气体后,品红溶液红色消失,证明该气体一定是SO2 |
4.现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②乙醇水溶液 ③氯化钠和单质溴的水溶液 ④碳酸钙和氯化钙溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏、蒸发 | B. | 萃取、蒸馏、分液、过滤 | ||
| C. | 分液、蒸馏、萃取、过滤 | D. | 蒸馏、萃取、分液、过滤 |
11.下列各溶液中,Na+物质的量浓度最大的是( )
| A. | 200 mL 0.5mol/LNaCl溶液 | B. | 50 mL 0.3mol/LNa2SO4溶液 | ||
| C. | 150 mL 0.4mol/LNaOH | D. | 200mL0.15mol/LNa3PO4 |
8.甲与乙在溶液中的转化关系如图所示(反应条件省略),甲不可能是( )


| A. | NH3 | B. | AlO2- | C. | CO32- | D. | CH3COO- |
16.有机物C5H11OH为饱和一元醇,其可能的结构共有( )
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
 .
.