题目内容
已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时的体积相同.发生反应:2NO2?N2O4一段时间后相继达到平衡状态.下列说法正确的是( )
| A、平衡时NO2的体积分数:甲>乙 |
| B、达到平衡所需要时间,甲比乙多 |
| C、平衡时的颜色,甲比乙深 |
| D、平衡时的平均相对分子质量:甲<乙 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同,容器乙中压强降低,容器甲体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(甲)>p(乙);
B、速率越快,到达平衡的时间越短;
C、平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变.
B、速率越快,到达平衡的时间越短;
C、平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变.
解答:
解:A、反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同,随反应进行,容器乙中压强降低,容器甲体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(甲)>p(乙),甲中平衡正向进行,平衡时NO2体积分数减小,甲<乙,故A错误;
B、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变,压强越大,反应速率越快,达到平衡所需时间甲短,故B错误;
C、NO2为红棕色气体,根据A的分析甲的压强大,增大压强,化学平衡向着正向移动,N2O4物质的量增大,又体积减小,所以浓度变大,在根据K=
不变,所以二氧化氮的浓度变大,颜色较深,所以平衡时的颜色,甲比乙深,故C正确;
D、平衡时的平均相对分子质量=
,反应前后总质量不变,根据以上分析,甲容器的压强大,增大压强,化学平衡向着正向移动,物质的量变小,所以甲中的平衡时的平均相对分子质量变大,故D错误;
故选C.
B、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变,压强越大,反应速率越快,达到平衡所需时间甲短,故B错误;
C、NO2为红棕色气体,根据A的分析甲的压强大,增大压强,化学平衡向着正向移动,N2O4物质的量增大,又体积减小,所以浓度变大,在根据K=
| c(N 2O 4) |
| c 2(NO 2) |
D、平衡时的平均相对分子质量=
| m(总) |
| n(总) |
故选C.
点评:本题考查影响化学反应速率和化学平衡的有关因素分析判断,主要是恒温恒容、恒温恒压容器特征的分析方法,掌握基础是关键,难度中等.

练习册系列答案
相关题目
常温下,有物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,下列说法不正确的是( )
| A、NaB溶液比NaA溶液更能促进水的电离 |
| B、将两溶液混合,混合溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) |
| C、NaA溶液中:c(Na+)-c(A-)=10-6mol/L |
| D、NaB溶液中:c(H+)+c(HB)=10-2mol/L |
下列关于有机物的说法中不正确的是( )
| A、正丁烷和异丁烷的一氯取代物都只有两种,它们的密度也相同 |
| B、乙烯、甲苯、乙酸分子中的碳原子都在同一平面上 |
| C、等物质的量的乙烯和乙醇蒸气完全燃烧消耗的氧气及生成的CO2的物质的量都相等 |
| D、0.3mol的混合烃充分燃烧后,标准状况下生成11.2L CO2气体,该烃中一定含有甲烷 |
下列说法正确的是( )
| A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
| B、某溶液中由水电离出的c(H+)=1.0×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液中:c(R2-)+c(HR-)=c(Na+) |
| D、相同物质的量浓度的①NH4Al(SO4)2 ②NH4Cl③CH3COONH4 ④NH3?H2O溶液中,c(NH4+)由大到小的顺序是:①>②>③>④ |
已知O4是氧元素的一种新的单质,它具有强氧化性,能将Fe2+氧化为Fe3+,其方程式为 O4+Fe2++-Fe3++H2O+O2 (未配平).下列说法正确的是( )
| A、O4和O2是同种物质,都大量存在于空气中 |
| B、该反应需要在酸性条件下进行 |
| C、每生成22.4L O2将转移4NA个电子 |
| D、64gO4和O2的混合气体所含有的分子数为2NA |
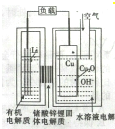 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |