题目内容
 我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3
| ||
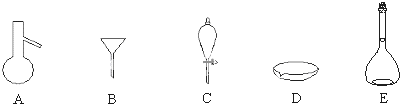
某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置实验室可选药品有浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵,氯化钠.
(1)选用最合适的试剂的名称A
(2)本实验具体操作过程中,应先通
(3)指出该装置的至少两处错误
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5g,实验最后得到无水碳酸钠26g,则其产率为
(5)在“侯氏制碱法”的工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?
考点:探究碳酸钠与碳酸氢钠的性质
专题:实验题
分析:根据反应原理,实验操作过程为:先制得NH3(左边装置)和CO2(右边装置),再将制得的气体依次通入B装置中饱和食盐水中即得碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱,
(1)A中试剂通过加热制取氨气,可以选用氢氧化钙与和氯化铵;D装置中的试剂与大理石反应生成二氧化碳气体,可以选用稀盐酸;
(2)二氧化碳不易溶于水,氨气极易溶于水,据此判断通入氨气、二氧化碳气体的顺序;
(3)氨气极易溶于水,导管不能伸入液面以下、BC间缺少止水夹、装置B应该与大气相通;
(4)根据反应方程式找出关系式,根据氯化钠的质量计算出理论上生成碳酸钠的质量,然后计算出产率;根据碳酸氢钠的溶解度较大分析;
(5)根据制备原理判断反应过程中可以重复利用的物质.
(1)A中试剂通过加热制取氨气,可以选用氢氧化钙与和氯化铵;D装置中的试剂与大理石反应生成二氧化碳气体,可以选用稀盐酸;
(2)二氧化碳不易溶于水,氨气极易溶于水,据此判断通入氨气、二氧化碳气体的顺序;
(3)氨气极易溶于水,导管不能伸入液面以下、BC间缺少止水夹、装置B应该与大气相通;
(4)根据反应方程式找出关系式,根据氯化钠的质量计算出理论上生成碳酸钠的质量,然后计算出产率;根据碳酸氢钠的溶解度较大分析;
(5)根据制备原理判断反应过程中可以重复利用的物质.
解答:
解:根据反应原理可知,制备纯碱的实验操作过程为:先制得NH3(左边装置)和CO2(右边装置),再将制得的气体依次通入B装置中饱和食盐水中即得碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱,
(1)试剂A用于制取氨气,可以选用氯化铵和熟石灰;试剂B与大理石反应制取二氧化碳气体,则试剂B为稀盐酸,
故答案为:氯化铵和熟石灰;稀盐酸;
(2)CO2在水中溶解度小,氨气极易溶于水,则先通NH3至饱和,然后通入二氧化碳气体,有利于NaHCO3析出,
故答案为:NH3;CO2;CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出;
(3)根据图示装置可知,该装置的错误有:BC之间缺少止水夹、B装置应与大气相通、通NH3的导管不应伸入液面以下,
故答案为:BC之间缺少止水夹、B装置应与大气相通(或通NH3的导管不应伸入液面以下);
(4)根据反应NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3
Na2CO3+CO2↑+H2O可得关系式:2NaCl~Na2CO3,58.5gNaCl的物质的量为:n(NaCl)=
=1mol,1mol氯化钠完全反应理论上生成0.5mol碳酸钠,
则碳酸钠的产率为:
×100%≈49.1%;
如果操作正确,若碳酸氢钠的溶解度较大,会导致碳酸氢钠没有完全沉淀出来,所以碳酸钠的产率降低,
故答案为:49.1%;NaHCO3在水中有较大的溶解度,未能全部沉淀出来;
(5)根据反应方程式NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3
Na2CO3+CO2↑+H2O可知,NH4Cl、CO2可以循环利用,
故答案为:NH4Cl、CO2.
(1)试剂A用于制取氨气,可以选用氯化铵和熟石灰;试剂B与大理石反应制取二氧化碳气体,则试剂B为稀盐酸,
故答案为:氯化铵和熟石灰;稀盐酸;
(2)CO2在水中溶解度小,氨气极易溶于水,则先通NH3至饱和,然后通入二氧化碳气体,有利于NaHCO3析出,
故答案为:NH3;CO2;CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出;
(3)根据图示装置可知,该装置的错误有:BC之间缺少止水夹、B装置应与大气相通、通NH3的导管不应伸入液面以下,
故答案为:BC之间缺少止水夹、B装置应与大气相通(或通NH3的导管不应伸入液面以下);
(4)根据反应NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3
| ||
| 58.5g |
| 58.5g/mol |
则碳酸钠的产率为:
| 26g |
| 106g/mol×0.5mol |
如果操作正确,若碳酸氢钠的溶解度较大,会导致碳酸氢钠没有完全沉淀出来,所以碳酸钠的产率降低,
故答案为:49.1%;NaHCO3在水中有较大的溶解度,未能全部沉淀出来;
(5)根据反应方程式NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3
| ||
故答案为:NH4Cl、CO2.
点评:本题以侯氏制碱法的原理为切入点,分别考查药品的选用、操作过程分析、实验装置评价、化学计算、化工生产原理等知识,题目难度中等,正确分析题干信息为解答关键,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
X、Y、Z分别是三种非金属单质,M、N、R是三种常见的氧化物,只有一种氧化物具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)R+X→Y+N.下列说法正确的是( )
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
下列实验设计和结论相符的是( )
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
常温下,有物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,下列说法不正确的是( )
| A、NaB溶液比NaA溶液更能促进水的电离 |
| B、将两溶液混合,混合溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) |
| C、NaA溶液中:c(Na+)-c(A-)=10-6mol/L |
| D、NaB溶液中:c(H+)+c(HB)=10-2mol/L |
下列说法正确的是( )
| A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
| B、某溶液中由水电离出的c(H+)=1.0×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液中:c(R2-)+c(HR-)=c(Na+) |
| D、相同物质的量浓度的①NH4Al(SO4)2 ②NH4Cl③CH3COONH4 ④NH3?H2O溶液中,c(NH4+)由大到小的顺序是:①>②>③>④ |
 短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答: