题目内容
 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1、T3温度时达到化学平衡 |
| B、该反应在T1温度时达到化学平衡 |
| C、该反应为放热反应 |
| D、升高温度,平衡会向正反应方向移动 |
考点:体积百分含量随温度、压强变化曲线
专题:
分析:T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前是反应没有达到平衡状态,而T2℃时恰好平衡,T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应.
解答:
解:T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前是反应没有达到平衡状态,而T2℃时恰好平衡,T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应.
A、T1温度之后A%继续变小,C%继续增大,T3温度之后A%继续增大,C%继续减小,故T1、T3温度时未达到化学平衡,故A错误;
B、T1温度之后A%继续变小,C%继续增大,故T1温度时未达到化学平衡,故B错误;
C、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应,则正反应为放热反应,故C正确;
D、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向逆反应移动,故D错误.
故选C.
A、T1温度之后A%继续变小,C%继续增大,T3温度之后A%继续增大,C%继续减小,故T1、T3温度时未达到化学平衡,故A错误;
B、T1温度之后A%继续变小,C%继续增大,故T1温度时未达到化学平衡,故B错误;
C、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应,则正反应为放热反应,故C正确;
D、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向逆反应移动,故D错误.
故选C.
点评:本题考查化学平衡图象、温度对化学平衡的影响,难度中等,明确图象中含量随温度的平衡关系判断T2℃时恰好平衡是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
HPE是合成除草剂的重要中间体,其结构简式如图所示.有关HPE的说法正确的是( )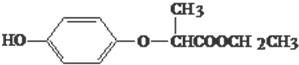

| A、HPE不能跟浓溴水反应 |
| B、1molHPE最多可以和2mol NaOH反应 |
| C、HPE在核磁共振氢谱中有6个峰 |
| D、HPE分子中有2个手性碳原子 |
X、Y、Z分别是三种非金属单质,M、N、R是三种常见的氧化物,只有一种氧化物具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)R+X→Y+N.下列说法正确的是( )
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
常温下,有物质的量浓度、体积都相同的NaA(pH=8)和NaB(pH=12)溶液,下列说法不正确的是( )
| A、NaB溶液比NaA溶液更能促进水的电离 |
| B、将两溶液混合,混合溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) |
| C、NaA溶液中:c(Na+)-c(A-)=10-6mol/L |
| D、NaB溶液中:c(H+)+c(HB)=10-2mol/L |
下列说法不正确的是( )
| A、通过煤的干馏可获得苯、甲苯等芳香烃 |
| B、在海轮外壳装上锌块,可减缓船体的腐蚀速率 |
| C、电渗析法、离子交换法法中,只有后者可以应用于海水的淡化 |
| D、我国城市推广使用清洁燃料是压缩天然气类和液化石油气类 |
已知O4是氧元素的一种新的单质,它具有强氧化性,能将Fe2+氧化为Fe3+,其方程式为 O4+Fe2++-Fe3++H2O+O2 (未配平).下列说法正确的是( )
| A、O4和O2是同种物质,都大量存在于空气中 |
| B、该反应需要在酸性条件下进行 |
| C、每生成22.4L O2将转移4NA个电子 |
| D、64gO4和O2的混合气体所含有的分子数为2NA |
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.