题目内容
2.有以下几种物质:①食盐晶体 ②铜 ③KNO3溶液 ④熔融的氢氧化钾 ⑤液态氯化氢 ⑥二氧化碳 ⑦酒精.回答以下问题(填序号):以上物质中能导电的是②③④; 属于电解质的是①④⑤;属于非电解质的是⑥⑦.
分析 (1)能导电的物质,必须具有能自由移动的带电的微粒,金属能导电是由于金属中存在能自由移动的带负电的电子;
(2)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
(3)在水溶液里和熔融状态下都不导电的化合物是非电解质.
解答 解:(1)能导电的物质,必须具有能自由移动的带电的微粒,金属②铜中存在能自由移动的带负电的电子能导电;③KNO3溶液中有自由移动的离子,能导电;④熔融的氢氧化钾中有能自由移动的正负离子,也能导电.
故答案为:②③④;
(2)电解质是在水溶液中或熔融状态下能够导电的化合物,满足该条件的有:①食盐晶体、④熔融的氢氧化钾、⑤液态氯化氢,
故答案为:①④⑤
(3)⑥二氧化碳虽然在水溶液中能导电,但不是由于自身电离出离子,所以为非电解质,⑦酒精在水溶液里或熔融状态下都以分子存在,所以是非电解质,故答案为:⑥⑦.
点评 本题考查了电解质与非电解质的判断、溶液导电性判断,题目难度不大,注意电解质和非电解质都是针对化合物而言的,单质、混合物既不是电解质也不是非电解质

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.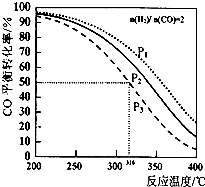 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
13.下列描述不涉及化学变化的是( )
| A. | 铁粉作袋装食品的抗氧化剂 | B. | 二氧化硫作纸浆的漂白剂 | ||
| C. | 氢氟酸作普通玻璃的刻蚀剂 | D. | 有机溶剂作食用油的萃取剂 |
10.向含有a mol Na2CO3的溶液中通入b molHCl,下列说法不正确的是( )
| A. | 当b>2a时,发生的离子反应为:CO32-+2H+=H2O+CO2↑ | |
| B. | 当b<a时,发生的离子反应为:CO32-+H+=HCO3- | |
| C. | 当4a=3b时,发生的离子反应为:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 当a<b<2a时,反应生成的HCO3-与CO2的物质的量之比为(b-a):(2b-a) |
17.下列指定反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 向0.1mol/L pH=1的KHA溶液中加入KOH溶液:H++OH-═H2O | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
4.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO(g)+Cl2(g)?2NOCl(g),在2L恒温密闭容器中分别进行实验①和实验②,部分实验数据见下表:下列说法中不正确的是( )
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
1.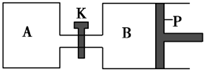 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |
2.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g),忽略固体体积,平衡时G的体积分数(%)的温度和压强的变化如下表所示.
①b<f;②915℃,2.0MPa时E的转化率为60%;③该反应的△S>0;④K(1000℃)>K(810℃).
上述①~④中正确的有( )
| 1.0MPa | 2.0MPa | 3.0MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
上述①~④中正确的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |