题目内容
6.向2L的密闭容器中充入3molN2和9molH2,在一定温度下,反应30s达到平衡,测得平衡时混合气体总物质的量比反应前混合气体总物质的量减少了$\frac{1}{8}$,平衡时N2的转化率为25%,30s内NH3的平均反应速率为0.025mol/(L•s).分析 相同条件下的密闭容器中,气体的压强与物质的量成正比,平衡时混合气体总物质的量比反应前混合气体总物质的量减少了$\frac{1}{8}$,则反应后气体的物质的量减少了:(3mol+9mol)×$\frac{1}{8}$=1.5mol,利用差量法计算出消耗氮气、生成氨气的物质的量,然后分别计算出氮气的转化率及30s内NH3的平均反应速率.
解答 解:相同条件下的密闭容器中,气体的压强与物质的量成正比,平衡时混合气体总物质的量比反应前混合气体总物质的量减少了$\frac{1}{8}$,则反应后气体的物质的量减少了:(3mol+9mol)×$\frac{1}{8}$=1.5mol
N2 +3H2 ?2NH3 △n
1 3 2 2
0.75mol 1.5mol 1.5mol
平衡时氮气的转化率为:$\frac{0.75mol}{3mol}$×100%=25%;
30s内NH3的平均反应速率为:$\frac{\frac{1.5mol}{2L}}{30s}$=0.025mol/(L•s),
故答案为:25%;0.025mol/(L•s).
点评 本题考查了化学平衡的计算,题目难度不大,明确物质的量与压强的关系为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
6.下列实验设计方案中,可行的是( )
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
1.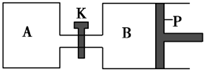 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |
15.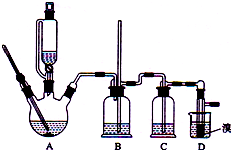 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在A装置的实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在A装置的实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发.
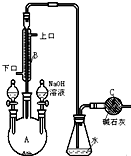 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: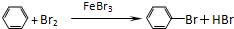 .
. +Br+→[
+Br+→[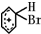 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)