题目内容
20.橙花醇可作为香料,其结构简式如图: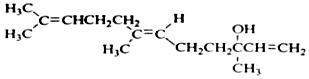 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
分析 该有机物含有碳碳双键,可发生加成、加聚、氧化反应,含有羟基,可发生氧化、消去和取代反应,以此解答该题.
解答 解:A.含有碳碳双键,可被酸性高锰酸钾氧化,故A正确;
B.含有碳碳双键和羟基,故B正确;
C.含有1个羟基,且结构不对称,则在浓硫酸催化下加热脱水,生成的产物不止一种,故C正确
D.有机物中含有3个碳碳双键,则1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗3mol溴,质量为480g,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于有机物知识的综合应用,题目难度中等,易错点为D,注意把握有机物的结构特点.

练习册系列答案
相关题目
10.同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,下列叙述中正确的( )
| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
11.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果.我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”.下列有关叙述正确的是( )
| A. | ①中水银“积变又还成丹砂”说明水银发生了还原反应 | |
| B. | ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu | |
| C. | 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒 | |
| D. | 水银能跟曾青发生置换反应生成单质铜 |
8.现有常温下pH=2的醋酸溶液,下列有关叙述正确的是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
5.在H2S水溶液中,加入一些Na2S固体,将使( )
| A. | H2S解离度增大 | B. | H2S平衡常数减小 | C. | 溶液pH下降 | D. | 溶液pH增大 |
6. 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
4.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀铜铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 铁制品长期与氯化铵溶液接触,易发生吸氧腐蚀 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |