题目内容
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
分析 设分解的N2O3的物质的量为x,则N205分解生成N2O3的物质的量为:0.02mol+x,N205分解生成O2的物质的量为0.02mol+x,N2O3分解生氧气的物质的量为x,则:0.02mol+x+x=0.14mol,据此可计算出分解的N2O3的物质的量,最后根据c=$\frac{n}{V}$计算出平衡时的c(N2O),据此进行解答.
解答 解:设分解的N2O3的物质的量为x,则N205分解生成N2O3的物质的量为:0.02mol+x,N205分解生成O2的物质的量为0.02mol+x,N2O3分解生氧气的物质的量为x,则:0.02mol+x+x=0.14mol,解得:x=0.06mol,
则平衡时分解的N2O3的物质的量为0.06mol,根据反应N2O3(g)?N2O(g)+O2(g)可知平衡时生成N2O的物质的量为0.06mol,
所以平衡时N2O浓度为:c(N2O)=$\frac{0.06mol}{2L}$=0.03mol/L,
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握可逆反应特点,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | H2SO4 | C. | SO2 | D. | NaCl |
6.下列各组离子能大量共存的是( )
| A. | 无色溶液中:Na+、Cu2+、NO3-、Cl- | |
| B. | 在pH=4的溶液中:Na+、K+、OH-、Cl- | |
| C. | 在含Ba2+的溶液中:H+、Na+、Cl-、SO42- | |
| D. | 与Fe反应产生气体的溶液:Na+、K+、Cl-、SO42- |
3.下列电池工作时,负极上有H2参与反应的是( )
| A. |  氢燃料电池 | B. |  锌锰碱性电池 | C. |  铅蓄电池 | D. |  银锌纽扣电池 |
10.下列有关0.10mol•L-1的NH4Cl溶液的叙述不正确的是( )
| A. | c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-) | ||
| C. | c(NH4+)+c(H+)=c(Cl-)+c(OH-) | D. | c(NH4+)+c(NH3.H2O)=0.10mol•L-1 |
20.橙花醇可作为香料,其结构简式如图: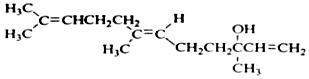 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )
 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
19.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.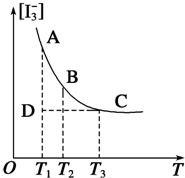 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).