题目内容
10.同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,下列叙述中正确的( )| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
分析 A.依据n=$\frac{m}{M}$计算判断;
B.同温同压下,气体密度之比等于其摩尔质量之比;
C.同温同压下,气体体积之比等于物质的量之比;
D.依据甲烷与一氧化氮物质的量及分子构成解答.
解答 解:A.依据n=$\frac{m}{M}$,质量一定时,n与M成反比,则等质量的甲烷(CH4)和N2O两种气体相比较,物质的量之比为:44:16=11:4,故A错误;
B.同温同压下,气体密度之比等于其摩尔质量之比,则同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,密度之比为:16:44=4:11,故B正确;
C.同温同压下,气体体积之比等于物质的量之比,则同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,体积之比为:44:16=11:4,故C错误;
D.同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,原子数之比为:11×5:4×3=55:12,故D错误;
故选:B.
点评 本题考查物质的量的有关计算,侧重学生计算能力的考查,注意把握有关计算公式及阿伏伽德罗定律的推论即可解答,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
20.以下物质与水混合后,滴入酚酞溶液不显红色的是( )
| A. | 氧化钠 | B. | 氯化钠 | C. | 碳酸钠 | D. | 氢氧化钠 |
1.下列叙述正确的是( )
| A. | 取等体积、pH相同的醋酸和盐酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n | |
| B. | 将pH=2的CH3COOH溶液加水稀释,水的电离平衡也向右移动 | |
| C. | 常温下,将pH=2的H2SO4与pH=12的NH3•H2O溶液等体积混合后,混合液pH<7 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:K+、Cu2+、Cl-、NO3- |
5.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | H2SO4 | C. | SO2 | D. | NaCl |
15.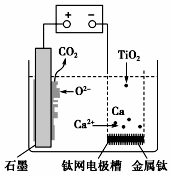 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
19.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130KJ/mol
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
20.橙花醇可作为香料,其结构简式如图: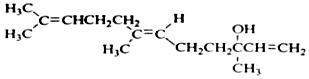 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )
 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |