题目内容
4.下列有关金属腐蚀与防护的说法正确的是( )| A. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀铜铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 铁制品长期与氯化铵溶液接触,易发生吸氧腐蚀 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
分析 A、纯银不能形成电化学腐蚀;
B、镀铜铁制品的镀层破损时形成原电池,铁做负极,铜做正极;
C、氯化铵溶液水解显酸性;
D、在电解池中阴极被保护,阳极可以被腐蚀.
解答 解:A、纯银不能形成原电池,即不能形成电化学腐蚀,故纯银在空气中发生的是化学腐蚀,故A正确;
B、镀铜铁制品的镀层破损时形成原电池,铁做负极被腐蚀,铜做正极被保护,故镀层失去了对铁的保护作用,且能加快铁的腐蚀,故B错误;
C、氯化铵溶液水解显酸性,故铁制品长期与氯化铵溶液接触,发生的是析氢腐蚀,故C错误;
D、在电解池中阴极被保护,阳极可以被腐蚀,故地下输油管应与外加电源的负极相连,故D错误.
故选A.
点评 本题考查了金属的腐蚀,应注意的是纯金属发生的是化学腐蚀,而合金发生的一般是电化学腐蚀,分清电解质溶液的性质对钢铁的析氢腐蚀和吸氧腐蚀的影响.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
20.橙花醇可作为香料,其结构简式如图: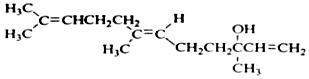 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )
 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
15.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )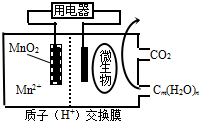

| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
12.离子反应方程式H++OH-=H2O,可表示的化学反应是( )
| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
19.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
9.对可逆反应N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1下列叙述正确的是( )
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,2v (H2) 正=3v (NH3) 逆 | |
| D. | 加入催化剂,正反应速率增大,逆反应速率不变 |
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
13.高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
14. 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2LN2中含电子总数为5NA | |
| B. | 标准状况下,22.4LN2H4中所含原子总数为6NA | |
| C. | 标准状况下,3.2gN2H4中含有共价键的总数为0.6NA | |
| D. | 若生成3.6gH2O,则上述反应转移电子的数目为0.2NA |