题目内容
3. I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为
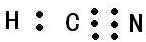 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
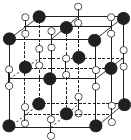
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
分析 (1)写出P的核外电子排布式,根据排布式确定电子占据的最高能级;基态N原子有多少个核外电子就有几种不同的运动状态;Br含有35个核外电子,基态电子排布式为s22s22p63s23p63d104s24p5,价电子排布式为4s24p5;
(2)HCN分子的结构式为H-C≡N,直线型结构,可根据结构式书写电子式,根据空间构型确定C的杂化形式;同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下电负性逐渐减弱;
(3)水解反应元素化合价不变,因此生成的两种酸为H3PO3和HCl,由H3PO3的电离平衡常数可知,存在两步电离,与足量的NaOH溶液反应生成Na2HPO3;
(4)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,据此答题;
Ⅱ.(5)晶格能越大熔点越高,晶格能与离子半径成反比,与所带电荷数呈正比;
(6)根据均摊法确定晶胞中各种原子的个数,再确定其化学式,根据密度确定晶胞的体积,进而求得晶胞的边长,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的$\frac{\sqrt{2}}{2}$,据此答题;
解答 解:(1)基态P原子的核外电子排布式为1s22s22p63s23p3,电子占据的最高能级符号为3p;
基态N原子核外有 7个电子,因此有7种运动状态不同的电子;
Br含有35个核外电子,基态电子排布式为s22s22p63s23p63d104s24p5,价电子排布式为4s24p5;
故答案为:3p;7;4s24p5;
(2)HCN分子的结构式为H-C≡N,电子式为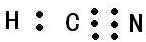 ,空间构型为直线型,中心原子C采取sp杂化;
,空间构型为直线型,中心原子C采取sp杂化;
同周期元素从左到右元素的电负性逐渐增强,则电负性:F>N,同主族元素从上到下电负性逐渐减弱,则电负性:N>P,则有电负性F>N>P,
故答案为: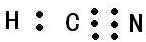 ;sp;F>N>P;
;sp;F>N>P;
(3)水解反应元素化合价不变,因此生成的两种酸为H3PO3和HCl,水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,由H3PO3的电离平衡常数可知,存在两步电离,与足量的NaOH溶液反应生成Na2HPO3,
故答案为:PCl3+3H2O?H3PO3+3HCl;Na2HPO3;
(4)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,比较表格中的数据可知,碘更容易形成较稳定的单核阳离子,故答案为:碘;
Ⅱ.(5)KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,TiN中离子都带3个单位电荷,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-<N3-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能TiN>MgO>CaO>KCl,故熔点TiN>MgO>CaO>KCl,
故答案为:TiN>MgO>CaO>KCl;
(6)根据均摊法可知晶胞中钙离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧离子的个数为12×$\frac{1}{4}$+1×1=4,故其化学式为CaO2,设晶胞的边长为a,根据ρ=$\frac{4×(40+32)}{{N}_{A}{a}^{3}}$,得a=$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cm,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的$\frac{\sqrt{2}}{2}$倍,即为的$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cm.
点评 本题为高考选作部分物质结构和性质的综合性答题,难度中等,涉及核外电子排布规律、电负性、晶格能、第一电离能的判断、杂化类型和空间结构的关系、晶胞的计算等知识点,考查非常全面,均为物质结构和性质的核心考点,每一小题之间联系不大,其中(3)为易错点,(6)为本题的难点.

| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
| A. | 臭氧空洞 | B. | 酸雨 | C. | 光化学烟雾 | D. | 温室效应 |
| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
| A. | 在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大 | |
| B. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| C. | 0.1 mol•L-1 Na2SO3溶液加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| D. | 常温下pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) |
| A. | 除去Fe2O3、Al2O3混合物中的Fe2O3加NaOH溶液 | |
| B. | 除去Na2O2中的Na2O,加热 | |
| C. | 除去Na2CO3固体中的NaHCO3,加NaOH固体 | |
| D. | 除去Fe、C合金中的C,在O2中灼烧 |
| A. | 过渡元素一定是金属元素 | |
| B. | 根据构造原理、泡利原理等核外电子排布规律可预测未来的第八周期包括的元素的种类有64个 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 原子最外层电子数为2的元素一定是 IIA元素 |
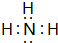 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.