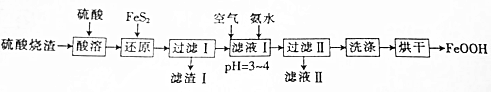
题目内容
11.9.8gH3PO4中含有H3PO4的分子数目是多少?分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
解答 解:n(H3PO4)=$\frac{9.8g}{98g/mol}$=0.1mol,则N(H3PO4)=0.1mol×6.02×1023/mol=6.02×1022,
答:9.8gH3PO4中含有H3PO4的分子数目是6.02×1022.
点评 本题综合考查物质的量的计算,侧重于学生计算能力的考查,为高考常见题型,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
3. I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.
(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为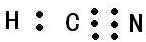 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
Ⅱ.(5)已知KC1、Mg0、Ca0、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的品格能数据:
则该四种晶体(不包括NaCl)的熔点从高到低的顺序为TiN>MgO>CaO>KCl
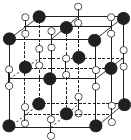
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为
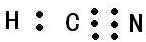 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
16.下列叙述不正确的是( )
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
6.下列有关平衡常数的说法中不正确的是( )
| A. | 温度一定时,一个给定的化学反应的平衡常数是一个常数 | |
| B. | 改变反应物浓度或生成物浓度会改变平衡常数 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度Qc<K时,反应向正反应方向进行 |
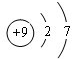 ,C2-的电子式
,C2-的电子式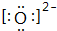 .
. .
.