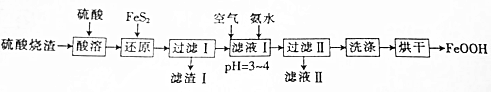
题目内容
17.下列关于元素周期表的结构、性质和用途叙述正确的是( )| A. | 过渡元素一定是金属元素 | |
| B. | 根据构造原理、泡利原理等核外电子排布规律可预测未来的第八周期包括的元素的种类有64个 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 原子最外层电子数为2的元素一定是 IIA元素 |
分析 A、过渡元素含副族和第ⅤⅢ族元素;
B、第七周期排满时,最后一种元素的价电子排布为7s27p6,第八周期排满时最后一种元素的价电子排布为8s28p6,从8s1到8s28p6,
其中间增排了8s25g1~186f147d108p6,核电荷数增加了50,故第八周期元素有50种;
C.金属与非金属交界处区域为半导体;
D、原子最外层电子数为2的元素可为He.
解答 解:A、过渡元素含副族和第ⅤⅢ族元素,则一定为金属元素,故A正确;
B、第七周期排满时,最后一种元素的价电子排布为7s27p6,第八周期排满时最后一种元素的价电子排布为8s28p6,从8s1到8s28p6,其中间增排了8s25g1~186f147d108p6,核电荷数增加了50,故第八周期元素有50种,而不是64个,故B错误;
C、应在由上角的非金属元素区寻找制备新型农药材料的元素,故C错误;
D、原子最外层电子数为2的元素可为He,另外ⅡB族元素的最外层电子数也为2,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质及周期中元素的种类数为解答的关键,注意性质与用途的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3. I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.
(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为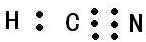 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
Ⅱ.(5)已知KC1、Mg0、Ca0、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的品格能数据:
则该四种晶体(不包括NaCl)的熔点从高到低的顺序为TiN>MgO>CaO>KCl
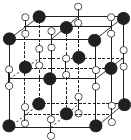
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为
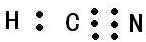 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
12.下列反应的化学方程式或离子方程式正确的是( )
| A. | 氢氧化亚铁被氧化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3+CO32- |
6.下列有关平衡常数的说法中不正确的是( )
| A. | 温度一定时,一个给定的化学反应的平衡常数是一个常数 | |
| B. | 改变反应物浓度或生成物浓度会改变平衡常数 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度Qc<K时,反应向正反应方向进行 |