题目内容
18.将下列溶液分别加入到FeCl3、Al2(SO4)3、Cu(NO3)2、MgCl2和Na2CO3五种溶液中,产生现象种类最多且把五种溶液区别开的是( )| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
分析 盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色、氢氧化铝的两性等角度判断.
解答 解:A.加入H2SO4溶液,FeCl3、Al2(SO4)3、Cu(NO3)2、MgCl2四种溶液都不反应,均无现象,不能鉴别,故A错误;
B.加入BaCl2溶液,Al2(SO4)3、Na2CO3均反应生成白色沉淀,另三种溶液都无现象,不能鉴别,故B错误;
C.加入NaOH溶液,FeCl3、Al2(SO4)3、Cu(NO3)2、MgCl2和Na2CO3五种溶液中现象分别为红褐色沉淀、先生成白色沉淀后溶解、蓝色沉淀、白色沉淀、无现象,产生现象种类最多且把五种溶液区别,故C正确;
D.加入硝酸银溶液,FeCl3、Al2(SO4)3、MgCl2、Na2CO3四种溶液都生成白色沉淀,反应现象相同,不能鉴别,故D错误;
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质之间的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.将等物质的量的Cl2和SO2气体通入BaCl2溶液中,再滴入紫色石蕊溶液,以下叙述正确的是( )
| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |
3. I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.
(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为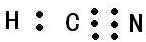 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
Ⅱ.(5)已知KC1、Mg0、Ca0、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的品格能数据:
则该四种晶体(不包括NaCl)的熔点从高到低的顺序为TiN>MgO>CaO>KCl
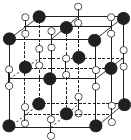
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4s24p5.
(2)HCN的电子式为
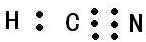 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,该水解反应的化学方程式为PCl3+3H2O?H3PO3+3HCl,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg.cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$cmcm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
12.下列反应的化学方程式或离子方程式正确的是( )
| A. | 氢氧化亚铁被氧化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3+CO32- |
 ,C2-的电子式
,C2-的电子式 .
. .
.