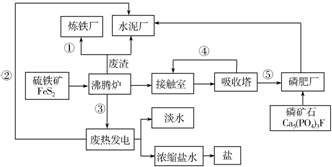
题目内容
6.下列实验装置,能达到实验目的是( )| A | B | C | D | |
| 装置 |  |  |  |  |
| 目的 | 收集NH3并验证其水溶液的碱性 | 制备氯气 | 配制-定浓度的NaOH溶液 | 加热明矾制备无水硫酸铜 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气极易溶于水,伸入试管中的导气管不能插入酚酞中;
B.酸性高锰酸钾溶液能够将氯化氢氧化成氯气;
C.不能在容量瓶中溶解氢氧化钠固体;
D.加热固体中应该在坩埚中进行.
解答 解:A.图示装置中,导气管插入酚酞溶液中会发生倒吸现象,故A错误;
B.酸性高锰酸钾溶液在常温下能够将氯化氢氧化成氯气,该装置可以制备少量氯气,故B正确;
C.溶解氢氧化钠固体应该在烧杯中进行,不能用容量瓶溶解溶质,故C错误;
D.加热胆矾晶体失去结晶水制备无水硫酸铜,不能在蒸发皿中加热,应该选用坩埚,故D错误;
故选B.
点评 本题考查了常见实验装置的综合,题目难度中等,涉及气体的制备与检验、溶液的配制、固体加热等知识,明确化学实验基本操作方法为解答关键,注意掌握常见实验装置特点及应用方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
1.下列说法中,正确的是( )
| A. | 灼热的炭与CO2的反应既是氧化还原反应,又是放热反应 | |
| B. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| C. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
17. 常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
 常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )| A. | a点:c(CO32-)>c(HCO3-)>c(Cl-) | B. | b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
1.A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法不正确的是( )
| A. | 原子半径:C>D>A>B | |
| B. | A、C、D元素最高价氧化物的水化物间相互反应 | |
| C. | C、D、A、B四种元素的最高价化合价依次升高 | |
| D. | B元素在周期表中的位置为第二周第ⅥA族 |
11.在一定温度下,将6mol C02和8mol H2充入2L恒容密闭容器中,发生反应:C02(g)+3H2(g)?CH30H(g)+H20(g)△H<O,一段时间后达到平衡.反应过程中测定的数据如下表.下列说法正确的是( )
| t/min | 1 | 4 | 8 | 11 |
| N(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 反应前4min的平均速率v(C02)=0.45 mol/(L min) | |
| B. | 该温度下,该反应的平衡常数为0.5 | |
| C. | 其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大 | |
| D. | 达到平衡时,H2的转化率为25% |
18.不能将有机物鉴别开来的一组是( )
| A. | 用在空气中点燃的方法鉴别甲烷、乙烯和乙炔 | |
| B. | 用新制的氢氧化铜悬浊液鉴别乙酸、乙醇和乙醛三种液体 | |
| C. | 用酸性高锰酸钾溶液鉴别苯甲醇、苯酚、醛甲醛三种溶液 | |
| D. | 用溴水鉴别已烯、四氯化碳、乙苯三种溶液体 |
15.下列实验中均伴有颜色的变化,与其他颜色褪色原理不同的是( )
| A. | 臭氧使有色布条褪色 | B. | SO2使品红溶液褪色 | ||
| C. | 氯气使鲜花褪色 | D. | 过氧化钠使品红溶液褪色 |
16.某元素原子的原子核外有三个电子层,最外层电子数是4,该原子的原子序数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |