题目内容
1.下列说法中,正确的是( )| A. | 灼热的炭与CO2的反应既是氧化还原反应,又是放热反应 | |
| B. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| C. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
分析 反应物的总能量高于生成物的总能量为放热反应,新建生成与旧键断裂是化学变化中产生能量变化的主要原因.
解答 解:A.灼热的炭与二氧化碳的反应属于吸热反应,故A错误;B.氢氧化钡与氯化铵的反应为吸热反应,故B错误;C.化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因,故C正确;D.反应物的总能量高于生成物的总能量为放热反应,故D错误,故选C.
点评 本题主要考查的是吸热反应与放热反应的定义,难度不大,需要认真分析.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
9.元素周期表是元素周期律的反映,元素在周期表中的位置、元素的原子结构和元素的性质存在密切关系.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:
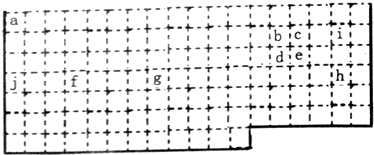
①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
①W2+的结构示意图 .
.
②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:

①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
13.下列说法正确的是( )
| A. | 可以用福尔马林(35%-40%的甲醛水溶液)浸泡海产品进行防腐保鲜 | |
| B. | 油脂是一种高分子化合物,工业上可以用它为原料制肥皂 | |
| C. | 屠呦呦在青蒿素的发现过程中起了关键作用,她也因此获2015年度诺贝尔化学奖 | |
| D. | 铁是人体健康、植物生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 |
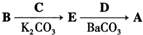
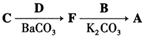
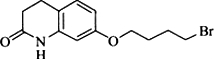 .其含氧官能团有肽键、醚键(写名称).
.其含氧官能团有肽键、醚键(写名称).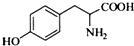 、
、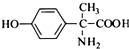 .
.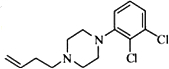 .
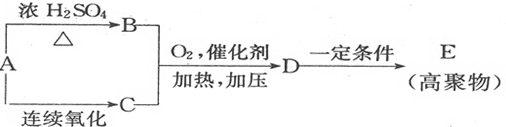
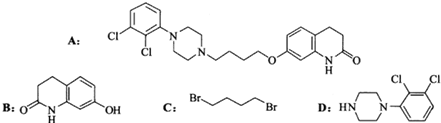
.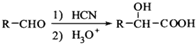 ,写出由C制备化合物
,写出由C制备化合物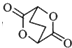 的合成路线流程图(无机试剂任选). (合成路线流程图示例如下:
的合成路线流程图(无机试剂任选). (合成路线流程图示例如下: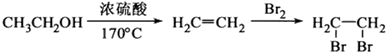 )
)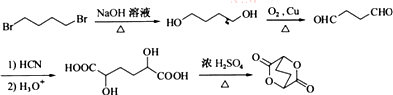 .
.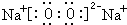 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.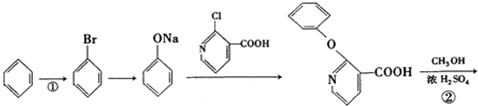

 +H2N-NH2→
+H2N-NH2→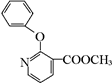 +CH3OH,
+CH3OH, ,
,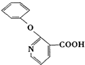 的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.
的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.


