题目内容
11.在一定温度下,将6mol C02和8mol H2充入2L恒容密闭容器中,发生反应:C02(g)+3H2(g)?CH30H(g)+H20(g)△H<O,一段时间后达到平衡.反应过程中测定的数据如下表.下列说法正确的是( )| t/min | 1 | 4 | 8 | 11 |
| N(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 反应前4min的平均速率v(C02)=0.45 mol/(L min) | |
| B. | 该温度下,该反应的平衡常数为0.5 | |
| C. | 其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大 | |
| D. | 达到平衡时,H2的转化率为25% |
分析 A.4min内H2物质的量变化为8mol-2.6mol=5.4mol,求出C02的物质的量变化,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(C02);
B.由表中数据可知8min时,反应到达平衡,根据平衡时H2的物质的量,利用三段式计算平衡时其它组分的物质的量代入平衡常数表达式计算;
C.根据温度对平衡的影响分析;
D.由表中数据可知8min时,反应到达平衡,根据平衡时H2的物质的量,利用转化率=$\frac{转化量}{总量}$计算.
解答 解:A.由表中数据4min内H2物质的量变化为:8mol-2.6mol=5.4mol,则消耗C02的物质的量$\frac{5.4mol}{3}$=1.8mol,所以v=$\frac{\frac{1.8mol}{2L}}{4min}$=0.225mol/(L•min),故A错误;
B. C02 (g)+3H2(g)?CH30H(g)+H20(g)
起始(mol/L) 3 4 0 0
转化(mol/L) 1 3 1 1
平衡(mol/L) 2 1 1 1
该温度下,该反应的平衡常数K=$\frac{1×1}{1×2}$=0.5,故B正确;
C正反应为放热反应,升高温度平衡向逆反应方向移动,反应达到新平衡时CH30H的体积分数减小,故C错误;
D.由表中数据可知8min时,反应到达平衡,平衡时H2的物质的量为2moL,则转化率=$\frac{8mol-2mol}{8mol}$×100%=75%,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率、化学平衡常数的表达式为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的化学计算能力.

 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
| A. | 甲烷 | B. | 苯 | C. | 乙酸丙酯 | D. | 乙二醛(OHC-CHO) |
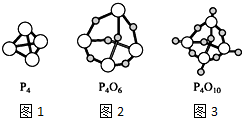 如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )
如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )| A. | P4O6中的磷原子采用sp2方式杂化 | |
| B. | 三氧化二磷、五氧化二磷这两个名称都表示分子的实际组成 | |
| C. | P4、P4O6和P4O10分子中同一P原子上两个化学键之间的夹角都是60° | |
| D. | P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体 |
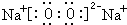 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
 .
.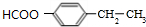 .
.







 .
.