题目内容
14.以下是某企业设计的硫酸--磷肥--水泥联产、海水--淡水多用、盐--热--电联产的三大生态产业链流程图.请根据流程回答下列问题:
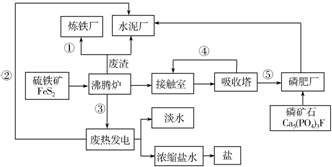
(1)该流程①、③、④为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:
①Fe2O3、③热能、④SO2.
(2)沸腾炉发生反应的化学方程式为4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙的化学方程式2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF.
(3)用1吨硫铁矿(FeS2的质量分数为72%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸0.78吨.[H-1 O-16 S-32 Fe-56]
(4)热电厂的冷却水是海水,该流程中浓缩盐水中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁.
①从离子的反应的角度思考,在浓缩盐水中加入石灰乳所起的作用是沉淀Mg2+.
②要利用MgCl2•6H2O制得无水氯化镁,应采取的措施是在干燥HCl气流中脱水,抑制MgCl2水解.
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气冷却剂的是A(填选项字母)
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
(5)炼铁过程中加入碳酸钙除去废渣中的含硅杂质.
分析 (1)根据流程图中工业生产的原料,及发生的反应中的能量转化分析;
(2)沸腾炉中FeS2与氧气反应;根据反应物、生成物及质量守恒定律形成该反应的方程式;
(3)根据FeS2制取硫酸过程中涉及的化学反应方程式,利用关系法解题;
(4)①石灰乳能将镁离子转化为沉淀;
②镁离子水解,应抑制其水解得到无水盐;
③用作镁蒸气的冷却剂,应不与Mg反应,以此来解答.;
(5)石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅.
解答 解:(1)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③沸腾炉中FeS2与氧气反应放出大量的热,④制硫酸时接触室中二氧化硫被氧化,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:①Fe2O3 ③热能 ④SO2 ;
(2)沸腾炉中FeS2与氧气反应生成Fe2O3和SO2,其反应方程式为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
普钙是磷酸二氢钙和硫酸钙,磷矿石和硫酸反应制普钙的化学方程式为:2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF,
故答案为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
(3)FeS2制取硫酸过程中,设生成的98%的硫酸为x吨,利用关系法列式,硫元素守恒,
FeS2 ~2H2SO4
120 2×98
1×72%×65% 98%x
则:$\frac{120}{1×72%×65%}$=$\frac{2×98}{98%x}$,解得:x=0.78,
故答案为:0.78;
(4)①石灰乳能将镁离子转化为沉淀,则在母液中加入石灰乳所起的作用是沉淀Mg2+,
故答案为:沉淀Mg2+;
②镁离子水解,应抑制其水解得到无水盐,所以利用MgCl2•6H2O制得无水氯化镁,应采取的措施是在干燥HCl气流中脱水,抑制MgCl2水解,
故答案为:在干燥HCl气流中脱水,抑制MgCl2水解;
③用作镁蒸气的冷却剂,应不与Mg反应,只有A符合,而Mg与二氧化碳、氧气、水蒸气等均可反应,
故答案为:A;
(5)石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,
故答案为:碳酸钙.
点评 本题考查了物质分离、提纯方法及其综合应用用,题目难度中等,涉及制备方案的设计、物质的分离与提纯方法、盐的水解原理、化学计算等知识,根据流程明确实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:
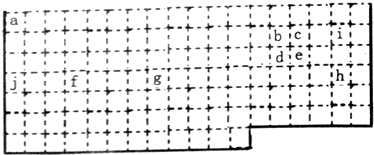
①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
| A. | $\frac{a}{m+A}$(A-N+m)mol | B. | $\frac{a}{A}$(A一N)mol | C. | $\frac{a}{m+A}$(A-N)mol | D. | $\frac{a}{A}$(A一N+m)mol |
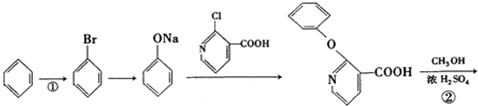

 +H2N-NH2→
+H2N-NH2→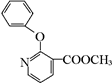 +CH3OH,
+CH3OH, ,
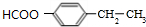
,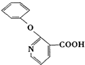 的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.
的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.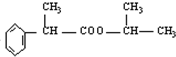
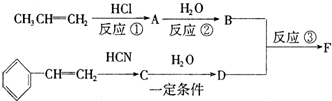
 .
. .
.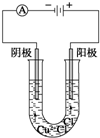 按如图所示装置进行探究实验:电解CuCl2溶液
按如图所示装置进行探究实验:电解CuCl2溶液






