题目内容
6.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)?CH3OH中能说明上述反应在一定条件下一定达到最大限度的是( )| A. | 反应物全部转化为甲醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应体系中甲醇的百分含量不再变化 | |
| D. | CO和H2以1:1的物质的量之比反应生成甲醉 |
分析 一定条件下一定达到最大限度,则反应达到平衡状态,正逆反应速率相等,但v≠0,各物质的含量、浓度不变,以此来解答.
解答 解:A.可逆反应中,反应物不能完全转化,故A错误;
B.正反应和逆反应的化学反应速率不等于0,平衡时为动态平衡,故B错误;
C.反应体系中甲醇的百分含量不再变化,达到平衡状态,达到最大限度,故C正确;
D.转化率未知,不能确定转化的最大限度,故D错误;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握平衡状态的特征、平衡移动原理为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
14.2008年北京奥运会“祥云”奥运火炬所用为环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ/mol
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2869.6kJ/mol
下列有关说法正确的是( )
CO:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ/mol
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2869.6kJ/mol
下列有关说法正确的是( )
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
1.在等温等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L.Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
11.下列说法正确的是( )
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{{c(N{H_3}•{H_2}O)•c({H^+})}}{{c(N{H_4}^+)}}$增大 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
18.现用浓度为0.1000mol/L的HCl溶液,测定某未知浓度的NaOH溶液:
(1)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,读取凹液面的最低点所对应的刻度作为终读数
(2)填写表中的空白处
(3)四组数据中,误差较大的是第1次,造成这种结果的原因可能是B
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(4)计算NaOH浓度平均值:0.1068mol/L.
(1)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,读取凹液面的最低点所对应的刻度作为终读数
(2)填写表中的空白处
| 实验次数 | V(NaOH) | V (HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(4)计算NaOH浓度平均值:0.1068mol/L.
15.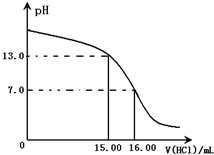 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).
Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).
由上图可知NaOH溶液的物质的量浓度为4.0mol/L(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了.对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计.
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关.
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是NaOH与空气中的CO2反应后的产物是碳酸钠,碳酸钠溶液显碱性,也可使酚酞试剂变红
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
(3)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失.因此酚酞红色褪去与氧气无关.若丁同学的猜想正确,设计如下实验证明并完成有关问题:
 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).
Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).由上图可知NaOH溶液的物质的量浓度为4.0mol/L(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了.对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计.
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关.
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是NaOH与空气中的CO2反应后的产物是碳酸钠,碳酸钠溶液显碱性,也可使酚酞试剂变红
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 | 设计这一步骤的目的 |
| (1)将配制的氢氧化钠溶液加热 | ① |
| (2)在加热后的溶液中滴加酚酞,并在上方滴一些植物油 | ②利用植物油隔绝空气 |
| 实验方法 | 观察到的现象 | 结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液. | 浓度大的溶液中红色会消失 | 红色消失与氢氧化钠溶液的浓度大小有关 |
| 方案二:向原红色消失的溶液中加 ①(填试剂名称) | ② |
16.下列有关钠的叙述中,正确的是( )
| A. | 钠是银白色金属,硬度很大 | |
| B. | 加热时,金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 将一块金属钠投入水中,钠将沉到水底 | |
| D. | 金属钠的熔点很高 |
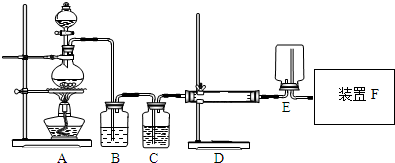

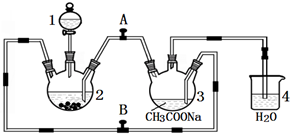 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示: