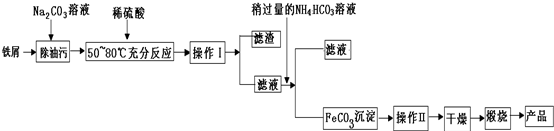
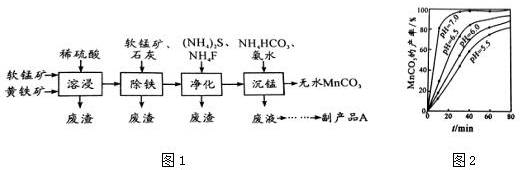
题目内容
14.2008年北京奥运会“祥云”奥运火炬所用为环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:CO:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ/mol
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2869.6kJ/mol
下列有关说法正确的是( )
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
分析 A、燃烧热是完全燃烧1mol物质生成稳定的产物所放出的热量;
B、根据燃烧的热化学方程式进行计算;
C、燃烧热是完全燃烧1mol物质生成稳定的产物所放出的热量;
D、人类利用的能源有太阳能、风能、光能、化学能等,据来源回答.
解答 解:A、根据正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2878.0kJ/mol知道,常温下正丁烷的燃烧热应为2878.0kJ/mol,故A错误;
B、丙烷燃烧时丙烷的质量、产生的热量以及消耗的氧气分别为44 g,2221.5kJ/mol,5 mol,正丁烷燃烧时正丁烷的质量、产生的热量以及消耗的氧气分别为58 g,2878.0 kJ/mol,6.5 mol,所以相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多,故B正确;
C、根据2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol知道:常温下,CO的燃烧热为283.0 kJ/mol,故C错误;
D、人类利用的能源可以不通过化学反应获得,如水力发电、风力发电、太阳能等,故D错误.
故选B.
点评 本题是一道关于化学反应中的能量变化的题目,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.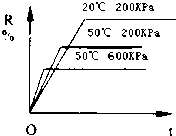 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )| A. | 正反应为放热反应,L为气体 | B. | 正反应为吸热反应,L为气体 | ||
| C. | 正反应为吸热反应,L为固体或液体 | D. | 正反应为放热反应,L为固体或液体 |
2.某工业反应为:X2(g)+3Y2(g)?2XY3(g).图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响.

下列说法正确的是( )

下列说法正确的是( )
| A. | 由图Ⅰ可知,加入适当的催化剂,E和△H都减小 | |
| B. | 图Ⅱ中0~10 min内该反应的平均速率v(Y2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(X2)的变化曲线为d | |
| C. | 图Ⅲ中a、b、c三点所处的平衡状态中,反应物X2的转化率最高的是b点 | |
| D. | 图Ⅲ中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1<T2,K1<K2 |
9.现有下列三个图象:
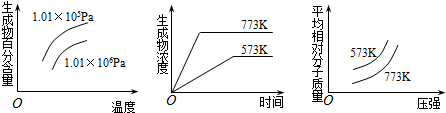
下列反应中全部符合上述图象的反应是( )

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |
19.可逆反应X(g)+Y(g)?2N(g)(正反应为放热反应)从反应开始到t1 s达到平衡,在t2 s末由于条件改变,平衡被破坏,在t3 s末又建立新的平衡.图中表示上述变化过程中X和N的浓度(c)与反应时间的关系.在t2 s~t3 s之间的曲线变化是由下列哪种条件改变引起的( )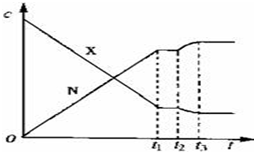

| A. | 降低温度 | B. | 增大N的浓度 | C. | 减小X的浓度 | D. | 增大压强 |
6.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)?CH3OH中能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | 反应物全部转化为甲醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应体系中甲醇的百分含量不再变化 | |
| D. | CO和H2以1:1的物质的量之比反应生成甲醉 |
4.甲醇是重要的化工原料和清洁液体燃料.工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
(l)反应①是放热反应(选填“吸热”“放热”.
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
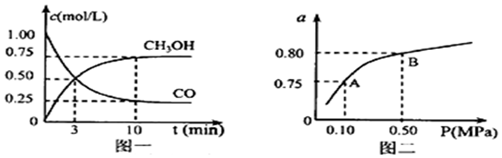
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.