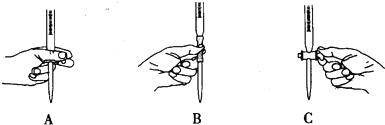
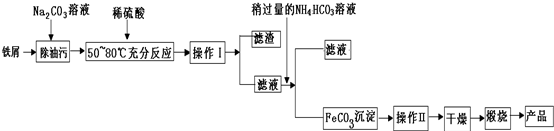
题目内容
16.AlCl3常作为有机合成和石油工业的催化剂,并用于处理润滑油等.已知无水AlCl3是白色晶体,易吸收水分,在178℃升华.装有无水AlCl3的试剂瓶久置潮湿的空气中会自动爆炸并产生大量白雾.工业上由金属Al和氯气作用制取,或由无水HCl气流与熔融金属Al作用而制得.
某课外兴趣小组在实验室里通过下列装置制取少量纯净的无水AlCl3.(其中B中盛有饱和食盐水)
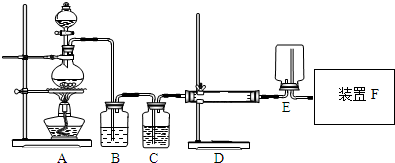
(1)写出无水HCl气流与熔融金属Al作用的化学方程式6HCl+2Al$\frac{\underline{\;熔融\;}}{\;}$2AlCl3+3H2↑
(2)A装置中发生的反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)若要收集一集气瓶纯净的氯气,从A到F装置中选取装置进行重新组装,必须依次选用的装置是A、B、C、E、F
(4)若用如图装置来制备纯净的AlCl3,还缺少的实验仪器是酒精灯,画出装置图F并标注所盛药品

(5)在D管内发生反应的化学方程式为:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3.
(6)无水AlCl3在潮湿空气中会产生大量白雾,有关反应的化学方程式为:AlCl3+3H2O═Al(OH)3+3HCl.
(7)若D中放入炽热的焦炭,由A装置导出的氯气只经过 B 后就直接进入 D管,在D管中生成气体甲和气体乙,已知气体甲能使澄清石灰水变浑浊,写出D管中发生的反应C+2Cl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl.
(8)将D管中产生的气体(不考虑多余的氯气)持续通入含物质的量为b mol的NaAlO2溶液中,能观察到先沉淀后溶解,通入的气体从开始沉淀到沉淀刚好完全溶解,消耗气体总物质的量最少是4bmol.
分析 B装置中盛放饱和食盐水,则A装置用于制取氯气,实验室用浓盐酸和二氧化锰制取氯气,生成的氯气中含有HCl,用饱和食盐水除去氯气中的HCl,C装置干燥氯气,D中Al和氯气在加热条件下反应生成氯化铝,E中收集氯化铝晶体,F中处理尾气,且吸收空气中水蒸气;
(1)无水HCl气流与熔融金属Al作用生成氯化铝和氢气,根据反应物、生成物和反应条件书写方程式;
(2)A装置中二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)若要收集一集气瓶纯净的氯气,用A制取氯气、B除杂、C干燥氯气、E收集气体、F处理尾气;
(4)若用如图装置来制备纯净的AlCl3,在D处需要加热,装置图F能吸收氯气和水蒸气;
(5)在D管内Al和氯气反应生成氯化铝;
(6)无水AlCl3在潮湿空气中会产生大量白雾,原因是氯化铝和水发生水解反应生成氢氧化铝和HCl;
(7)若D中放入炽热的焦炭,由A装置导出的氯气只经过 B 后就直接进入 D管,在D管中生成气体甲和气体乙,已知气体甲能使澄清石灰水变浑浊,则甲是二氧化碳,C和水蒸气在加热条件下反应生成二氧化碳和氢气,氢气和氯气反应生成HCl,则乙是HCl;
(8)将D管中产生的气体(不考虑多余的氯气)持续通入含物质的量为b mol的NaAlO2溶液中,能观察到先沉淀后溶解,通入的气体从开始沉淀到沉淀刚好完全溶解,
发生的反应有Cl2+H2O=HCl+HClO、4HCl+NaAlO2=AlCl3+NaCl+2H2O,
根据这两个方程式得4Cl2+2H2O+NaAlO2=4HClO+AlCl3+NaCl,根据氯气和偏铝酸钠的关系式计算.
解答 解:B装置中盛放饱和食盐水,则A装置用于制取氯气,实验室用浓盐酸和二氧化锰制取氯气,生成的氯气中含有HCl,用饱和食盐水除去氯气中的HCl,C装置干燥氯气,D中Al和氯气在加热条件下反应生成氯化铝,E中收集氯化铝晶体,F中处理尾气,且吸收空气中水蒸气;
(1)无水HCl气流与熔融金属Al作用生成氯化铝和氢气,根据反应物、生成物和反应条件书写方程式为6HCl+2Al $\frac{\underline{\;熔融\;}}{\;}$2AlCl3+3H2↑,
故答案为:6HCl+2Al $\frac{\underline{\;熔融\;}}{\;}$2AlCl3+3H2↑;
(2)A装置中二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(3)若要收集一集气瓶纯净的氯气,用A制取氯气、B除杂、C干燥氯气、E收集气体、F处理尾气,所以需要的装置是A、B、C、E、F,故答案为:A、B、C、E、F;
(4)若用如图装置来制备纯净的AlCl3,在D处需要加热,所以D处需要酒精灯,装置图F能吸收氯气和水蒸气,F中加入的物质是碱石灰,F装置为 ,
,
故答案为:酒精灯; ;
;
(5)在D管内Al和氯气反应生成氯化铝,反应方程式为2Al+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3,故答案为:2Al+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3;
(6)无水AlCl3在潮湿空气中会产生大量白雾,原因是氯化铝和水发生水解反应生成氢氧化铝和HCl,生成的HCl遇水蒸气形成雾,反应方程式为AlCl3+3H2O═Al(OH)3+3HCl,
故答案为:AlCl3+3H2O═Al(OH)3+3HCl;
(7)若D中放入炽热的焦炭,由A装置导出的氯气只经过 B 后就直接进入 D管,在D管中生成气体甲和气体乙,已知气体甲能使澄清石灰水变浑浊,则甲是二氧化碳,C和水蒸气在加热条件下反应生成二氧化碳和氢气,氢气和氯气反应生成HCl,则乙是HCl,反应方程式为C+2Cl2+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl,
故答案为:C+2Cl2+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl;
(8)将D管中产生的气体(不考虑多余的氯气)持续通入含物质的量为b mol的NaAlO2溶液中,能观察到先沉淀后溶解,通入的气体从开始沉淀到沉淀刚好完全溶解,
发生的反应有Cl2+H2O=HCl+HClO、4HCl+NaAlO2=AlCl3+NaCl+2H2O,
根据这两个方程式得4Cl2+2H2O+NaAlO2=4HClO+AlCl3+NaCl,根据氯气和偏铝酸钠的关系式知,bmol偏铝酸钠完全反应最少消耗氯气4bmol,
故答案为:4b.
点评 本题考查物质制备,为高频考点,侧重考查学生获取信息、筛选信息、利用信息解答问题能力,明确化学反应原理、元素化合物性质、物质之间的转化是解本题关键,注意:如果没有装置F,会导致E中氯化铝和水蒸气反应且会污染空气,注意(8)题发生的反应,题目难度不大.

 名校课堂系列答案
名校课堂系列答案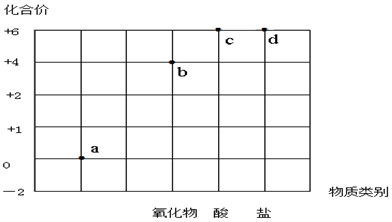
| A. | a点表示的物质所属的物质类别是单质 | |
| B. | b点表示的物质可以是SO2或SO3 | |
| C. | c点表示的化合物的浓溶液可作为干燥剂 | |
| D. | d点表示的可溶性物质能与BaCl2溶液发生反应 |
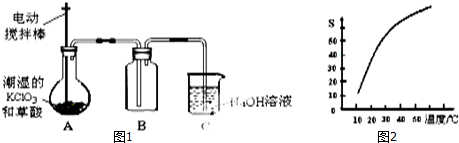
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

(1)图1中装置A的仪器①、②名称分别为温度计、圆底烧瓶_;
(2)实验过程中向B装置(溴水)中通入制备所得到的气体,溶液的颜色很快褪去,分析使B中溶液褪色的物质:
a.甲认为是C2H4.根据甲的判断,写出反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br;该反应属于加成反应(填反应类型);
b.乙根据现象Ⅲ认为,在制取乙烯的实验中因温度过高使乙醇和浓硫酸反应生成少量的SO2,不能排除SO2的影响.根据乙的观点,写出在B中与SO2 反应使溶液褪色的反应方程式SO2+Br2+2H2O=2H2SO4+2HBr;
II.有人设计如图2装置进行实验以确认上述混合气体中有乙烯及二氧化硫.试回答下列问题:
(3)图中①②③④装置内,添加选择合适的试剂进行实验,以确认混合气体内的成分(按照仪器顺序从左到右填序号,可重复选择试剂):①A;②B;③A;④D;
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(4)根据装置内所选择的试剂,能说明二氧化硫气体存在的现象是装置①品红溶液褪色;使用装置②的目的是除去混合气体中的SO2,避免干扰实验结果;
(5)确定含有乙烯的现象是装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.
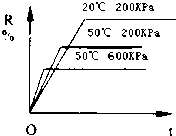 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )| A. | 正反应为放热反应,L为气体 | B. | 正反应为吸热反应,L为气体 | ||
| C. | 正反应为吸热反应,L为固体或液体 | D. | 正反应为放热反应,L为固体或液体 |
| A. | 反应物全部转化为甲醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应体系中甲醇的百分含量不再变化 | |
| D. | CO和H2以1:1的物质的量之比反应生成甲醉 |