题目内容
16.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是Z元素形成的单质是空气的主要成分之一.已知:甲+乙═丁+己,甲+丙═戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
分析 0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是Z元素形成的单质是空气的主要成分之一,则己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,结合原子数可知,X为H元素、则Y为C元素、Z为O元素、W为Na元素.
解答 解:0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是Z元素形成的单质是空气的主要成分之一,则己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,结合原子数可知,X为H元素、则Y为C元素、Z为O元素、W为Na元素.
A.所有元素中氢原子半径最小,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O>H,即原子半径:W>Y>Z>X,故A错误;
B.Y为碳元素,处于周期表中第二周期IVA族,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,故C正确;
D.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误.
故选C.
点评 本题考查元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,D选项注意盐类水解.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
6.下列化合物的核磁共振氢谱中出现一组峰的是( )
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二甲基己烷 | D. | 2,5一二甲基己烷 |
7.下列物质中含有NA个氯化氢分子的是( )
| A. | 将1mol H2和1mol Cl2 光照或点燃后的产物 | |
| B. | 室温下22.4L HCl气体 | |
| C. | 室温下,将1mol HCl气体通入100mL水中所得溶液 | |
| D. | 室温下,36.5g HCl气体 |
4.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )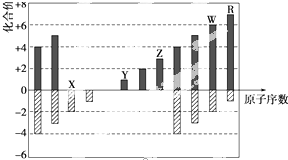

| A. | 原子半径:Z>Y>X | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | R的单质可以从W的气态氢化物的水溶液中置换出W的单质 | |
| D. | Z的最高价氧化物对应的水化物既能溶解于盐酸,又能溶解于氨水 |
5.3.04g铜镁合金完全溶解于100mL14.0mol•L-1的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.0mol•L-1NaOH溶液,当金属离子完全沉淀时,得到5.08g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 被还原的硝酸的物质的量是0.12mol | |
| C. | 得到5.08g沉淀时,加入NaOH溶液的体积是700mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
9.地壳中含量居于第二位的金属元素是( )
| A. | Al | B. | Si | C. | Fe | D. | O |
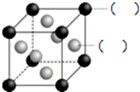 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题: ;
;