题目内容
7.下列物质中含有NA个氯化氢分子的是( )| A. | 将1mol H2和1mol Cl2 光照或点燃后的产物 | |
| B. | 室温下22.4L HCl气体 | |
| C. | 室温下,将1mol HCl气体通入100mL水中所得溶液 | |
| D. | 室温下,36.5g HCl气体 |
分析 含有NA个氯化氢分子,即物质的量为1mol,
A、将1mol H2和1mol Cl2 光照或点燃后的产物为2mol;
B、状况不知,无法求体积求物质的量;
C、1mol HCl气体通入100mL水中所得溶液完全电离,溶液中无氯化氢分子;
D、36.5g HCl气体,物质的量为$\frac{36.5g}{36.5g/mol}$=1mol,所以分子的物质的量为 1mol.
解答 解:A、将1mol H2和1mol Cl2 光照或点燃后的产物为2mol,所以含有2NA个氯化氢分子,故A不符合;
B、状况不知,无法求体积求物质的量,故B不符合;
C、1mol HCl气体通入100mL水中所得溶液完全电离,溶液中无氯化氢分子,故C不符合;
D、36.5g HCl气体,物质的量为$\frac{36.5g}{36.5g/mol}$=1mol,所以分子的物质的量为 1mol,所以含有NA个氯化氢分子,故D符合;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
2.将HCl和NaCl分别溶于水.下列说法正确的是( )
| A. | HCl的离子键被破坏 | B. | NaCl的共价键被破坏 | ||
| C. | HCl和NaCl的化学键均遭破坏 | D. | HCl和NaCl的化学键均未遭破坏 |
12.下列选项不能表示离子反应方程式为H++OH-=H2O的是( )
| A. | NaOH+HCl→NaCl+H2O | B. | 2NaOH+H2SO4→Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4→BaSO4↓+2H2O | D. | Ba(OH)2+2HCl→BaCl2+2H2O |
16.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是Z元素形成的单质是空气的主要成分之一.已知:甲+乙═丁+己,甲+丙═戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
17.下列反应的离子方程式书写正确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
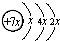 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.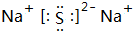 ;W2X2的结构式H-O-O-H.
;W2X2的结构式H-O-O-H. 分子结构中在同一平面上的碳原子数最多为11个.
分子结构中在同一平面上的碳原子数最多为11个.