题目内容
9.地壳中含量居于第二位的金属元素是( )| A. | Al | B. | Si | C. | Fe | D. | O |
分析 根据地壳中元素含量由高到低居前四位的元素依次是氧、硅、铝、铁进行解答.
解答 解:地壳中元素含量由高到低居前四位的元素依次是氧、硅、铝、铁,所以地壳中含量居第二位的金属元素是铁.
故选C.
点评 本题考查元素化合物知识,为高频考点,题目较为基础,为识记型题目,注意常见元素的种类以及在地壳中的含量,难度不大.

练习册系列答案
相关题目
16.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是Z元素形成的单质是空气的主要成分之一.已知:甲+乙═丁+己,甲+丙═戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
17.下列反应的离子方程式书写正确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
17.下列说法正确的是( )
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡 | |
| D. | 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应 |
4.自来水加工处理流程如图,下列有关说法不正确的是( ) 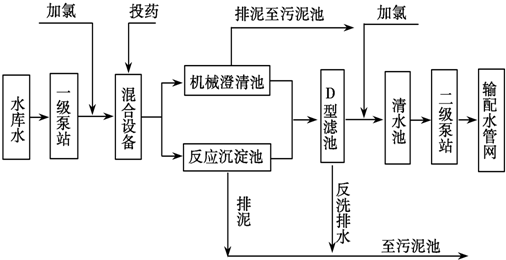

| A. | 若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 | |
| B. | 投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 | |
| C. | 自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 | |
| D. | 用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
14. 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
(1)下列事实能证明②的非金属性比⑦强的是CD
A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有离子键、共价键.
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:O2->Na+>Al3+.(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系.
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有离子键、共价键.
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:O2->Na+>Al3+.(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系.
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
18.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.