题目内容
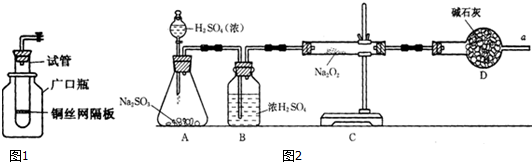
8.一种微生物燃料电池如下图所示,下列关于该电池的说法正确的是( )
| A. | a电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| B. | 电子流向为a→负载→b→质子交换膜→a | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 当有1mol电子转移时,正极产生2.24L气体 |
分析 b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,a电极是负极,发生失电子的氧化反应,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,
A、a电极是负极发生氧化反应;
B、原电池中电子从负极流向正极,据此回答;
C、原电池中阳离子从负极移向正极;
D、b极上N元素的化合价降低,所以b是正极发生还原反应,根据电极反应式进行计算.
解答 解:A、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,a电极是负极,发生失电子的氧化反应,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,故A正确;
B、原电池中电子从负极流向正极,只能经过导线,不能经过电解质,即电子流向为a→负载→b→,故B错误.
C、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故C错误;
D、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,当有1mol电子转移时,正极产生标况下的2.24L气体,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.

练习册系列答案
相关题目
16.下列关于普伐他汀的水解产物(结构简式如图)说法正确的是( )
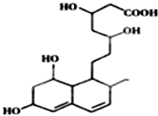

| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
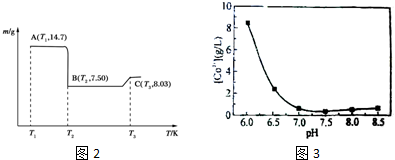
19.电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物.其工业制取流程如图1:

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
b.CoSO4与NH4HCO3反应时,母液中钴离子含量与溶液pH关系图如图3:
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+ 沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+ 沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.

3.下列离子方程式正确的是( )
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-═5SO42-+2Mn2++2H2O | |
| D. | 向AlCl3溶液滴入过量氨水:Al3++4OH-═AlO2-+2H2O |
20.短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )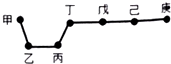

| A. | 单质甲与单质乙充分反应一定都可以生成多种化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊>丁 | |
| C. | 可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质 | |
| D. | 因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强 |
17.如表实验“操作和现象”与“结论”都正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的$\frac{2}{3}$处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A. | A | B. | B | C. | C | D. | D |
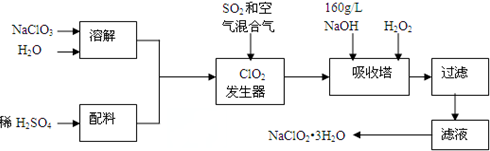
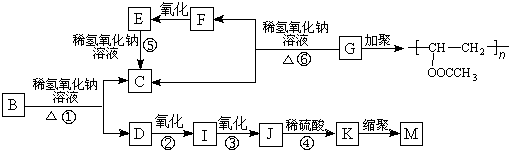
 .
.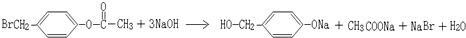 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: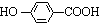 +NaOH→
+NaOH→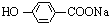 +H2O.
+H2O.