题目内容
8.下列关于NH4Fe(SO4)2溶液中离子浓度关系的说法中正确的是( )| A. | 2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | B. | c(NH4+)=c(Fe3+) | ||
| C. | c(NH4+)=$\frac{1}{2}$c(SO42-) | D. | c(OH-)>c(H+) |
分析 A.根据NH4Fe(SO4)2溶液中的电荷守恒判断;
B.由于铁离子和铵根离子发生水解,且水解程度不同,则其浓度不相同;
C.铵根离子部分水解,导致铵根离子浓度减小;
D.铵根离子、铁离子部分水解,溶液呈酸性.
解答 解:A.根据NH4Fe(SO4)2溶液中的电荷守恒可得:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+),故A正确;
B.由于铵根离子和铁离子都发生水解,且水解的程度不同,则c(NH4+)、c(Fe3+)不会相等,故B错误;
C.铵根离子发生水解,则c(NH4+)<$\frac{1}{2}$c(SO42-),故C错误;
D.铵根离子和铁离子发生水解,溶液呈酸性,则c(OH-)<c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用,他培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.下列叙述中正确的是( )
| A. | 若烃中碳、氢元素的质量分数相同,则为同系物 | |
| B. | CH2═CH2和CH2═CH-CH═CH2互为同系物 | |
| C. | 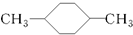 和 和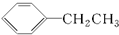 互为同分异构体 互为同分异构体 | |
| D. | 同分异构体的化学性质可能相似 |
19.在天平的两个托盘上,分别放上质量相等的两只烧杯,在烧杯中分别加入同组成、同体积的稀硫酸(过量),此时天平呈平衡状态,然后分别向两只烧杯中加入等质量的碳酸钠和碳酸氢钠,反应终止后,天平( )
| A. | 放Na2CO3的一端重 | B. | 两端仍平衡 | ||
| C. | 放NaHCO3的一端重 | D. | 无法判断 |
16.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
3.已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
| A. | -488.3 kJ•mol-1 | B. | -191 kJ•mol-1 | ||
| C. | -476.8 kJ•mol-1 | D. | -1 549.6 kJ•mol-1 |
13.下列物质中分子间能形成氢键的是( )
| A. | N2 | B. | HBr | C. | H2S | D. | NH3 |
20.碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如图.下列有关该物质的说法不正确的是( )

| A. | 分子式为C3H2O3 | |
| B. | 分子中σ键与π键个数之比为3:1 | |
| C. | 分子中既有极性键也有非极性键 | |
| D. | 分子中碳原子的杂化方式全部为sp2杂化 |
 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.