题目内容
17.写出能达到下列目的一种试剂:①除去CO2中的CO灼热的氧化铜;
②除去乙烷中的乙烯溴水;
③除去乙炔中的H2S、PH3CuSO4溶液.
分析 除杂质题至少要满足两个条件:加入的试剂只能与杂质反应,不能与原物质反应;反应后不能引入新的杂质.
①除去二氧化碳中混有的一氧化碳,可以根据一氧化碳具有的性质进行,一氧化碳具有可燃性和还原性;
②乙烯含有不饱和键,乙烷为饱和烃,乙烯与溴水反应,而乙烷不反应;
③硫化氢和硫酸铜反应生成沉淀,磷化氢具有还原性,能被+2铜氧化.
解答 解:①通过灼热的氧化铜,一氧化碳可以还原氧化铜生成二氧化碳,而二氧化碳不参与反应,可以除去一氧化碳,气体产物为二氧化碳,不引入新的杂质,
故答案为:灼热的氧化铜;
②乙烯中含有碳碳双键,乙烯和溴水发生加成反应生成液态的1、2-二溴乙烷,而乙烷不反应,则用溴水除去乙烷中的乙烯,且不会引入新杂质,
故答案为:溴水;
③硫化氢和硫酸铜反应生成沉淀,磷化氢易被硫酸铜氧化除去,反应为:11PH3+24CuSO4 +12H2O=3H3PO4 +24H2SO4+8Cu3P↓或PH3+8CuSO4+4H2O=H3PO4+8H2SO4+8Cu↓,
故答案为:CuSO4溶液.
点评 本题考查物质的分离除杂,题目难度不大,注意根据物质的性质选择适当的除杂剂,注意进行物质除杂时,可以根据物质的性质,采用物理或化学的方法除去,要求所选的除杂试剂只与杂质反应,不能与原有物质反应,且反应后不能生成新的杂质.

练习册系列答案
相关题目
8.下列关于NH4Fe(SO4)2溶液中离子浓度关系的说法中正确的是( )
| A. | 2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | B. | c(NH4+)=c(Fe3+) | ||
| C. | c(NH4+)=$\frac{1}{2}$c(SO42-) | D. | c(OH-)>c(H+) |
5.下列各组物质中,化学键类型完全相同的是( )
| A. | HI和NaI | B. | H2O2和CO2 | C. | Cl2和CCl4 | D. | MgCl2和NaBr |
2.下列说法不正确的是( )
| A. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| B. | 电镀时保持电流恒定,升高温度不改变电解反应速率 | |
| C. | 电解精炼铜电解槽底部会形成含少量Ag、Fe、Pt等金属的阳极泥 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 | |
| E. | MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,若电解电路中通过2mol电子,MnO2的理论产量为1mol | |
| F. | 燃料电池是将燃料燃烧所放出的能量转化为化学能的装置 |
9.某硝酸盐R(NO3)2受热分解为RO、NO2、O2,在标准状况下,将生成的气体充满一烧瓶,并将烧瓶倒置于水中,当烧瓶中液面不再上升时烧瓶内溶液浓度是( )
| A. | $\frac{4}{5}$mol•L-1 | B. | $\frac{1}{14}$mol•L-1 | C. | $\frac{1}{22.4}$mol•L-1 | D. | $\frac{1}{28}$mol•L-1 |
6.己知反应:①PbO2+4HCI═PbCl2+C12↑+2H20,②Cu+2Fe3+═Cu2++2Fe2+,③Cl2+2Fe2+═2Cl-+2Fe3+.则有关物质(离子)的氧化性由强到弱的顺序为( )
| A. | Cl2>Fe3+>Cu2+>PbO2 | B. | PbO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>PbO2>Cl2 | D. | Cu2+>Fe3+>Cl2>PbO2 |
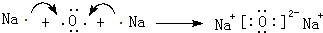 、
、 .
.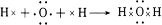 、
、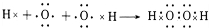 .
.