题目内容
3.已知下列反应的热化学方程式为(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
| A. | -488.3 kJ•mol-1 | B. | -191 kJ•mol-1 | ||
| C. | -476.8 kJ•mol-1 | D. | -1 549.6 kJ•mol-1 |
分析 ①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
据盖斯定律,(2)×2+(3)×2-(1)进行计算.
解答 解:已知(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
据盖斯定律,(2)×2+(3)×2-(1)得:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,
故选:A.
点评 本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,题目难度不大.

练习册系列答案
相关题目
13.元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
14.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | B. | 气态氢化物稳定性为:ZH3>H2Y>HX | ||
| C. | 非金属性:X>Y>Z | D. | 原子半径:X>Y>Z |
11.下列说法中错误的是( )
| A. | 氯气是一种黄绿色、有刺激性气味的气体 | |
| B. | 氯气、液氯和氯水是同一种物质 | |
| C. | 氯气能溶于水 | |
| D. | 氯气是一种有毒的气体,可用NaOH溶液吸收 |
18.下列化合物的核磁共振氢谱中出现峰个数最多的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
8.下列关于NH4Fe(SO4)2溶液中离子浓度关系的说法中正确的是( )
| A. | 2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | B. | c(NH4+)=c(Fe3+) | ||
| C. | c(NH4+)=$\frac{1}{2}$c(SO42-) | D. | c(OH-)>c(H+) |
15.下列化合物中含有手性碳原子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
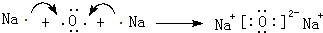 、
、 .
.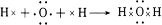 、
、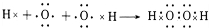 .
. 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.