题目内容
ClO2是一种黄绿色气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)、为原料制备ClO2的流程如图:
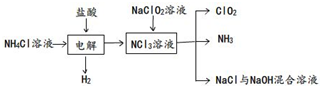
(1)写出电解时发生反应的化学方程式: .
(2)除去ClO2中的NH3可选用的试剂是 (填写字母).
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用50mL水溶解,再加3mL硫酸溶液,将生成的ClO2气体通入锥形瓶中完全吸收,在锥形瓶中加入几滴淀粉溶液,用0.10mol/L的硫代硫酸钠标准液滴定(I2+2S2O32-=2I-+S4O62-),共用去50.00mL标准液.
①ClO2通入锥形瓶中与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式 ;
②滴定终点现象是 ;
③测得ClO2的质量m(ClO2)= ;
(4)以N2、H2为电极反应物,以1L浓度均为0.05mol?L-1的HCl-NH4Cl混合液为电解质溶液的燃料电池,请写出电池工作时的正极反应式: .已知NH3?H2O在常温下的电离平衡常数为K,N2-H2燃料电池工作一段时间后溶液的pH=7,求电路中通过的电子的物质的量为 (用含K的代数式表示,假设NH3与H2O完全转化为NH3?H2O且忽略溶液体积的变化). 若有3克H2被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液,(假设以石墨为电极,整个过程中能量总利用率为80%),若要将CuSO4溶液恢复到原来的浓度,需加入 (填化学式),质量为: .

(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用50mL水溶解,再加3mL硫酸溶液,将生成的ClO2气体通入锥形瓶中完全吸收,在锥形瓶中加入几滴淀粉溶液,用0.10mol/L的硫代硫酸钠标准液滴定(I2+2S2O32-=2I-+S4O62-),共用去50.00mL标准液.
①ClO2通入锥形瓶中与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式
②滴定终点现象是
③测得ClO2的质量m(ClO2)=
(4)以N2、H2为电极反应物,以1L浓度均为0.05mol?L-1的HCl-NH4Cl混合液为电解质溶液的燃料电池,请写出电池工作时的正极反应式:
考点:制备实验方案的设计,化学电源新型电池,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2.
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体.据此判断.
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
(4)N2在正极发生还原反应生成NH4+,以此书写电极反应式;根据溶液pH=7可知溶液中c(OH-)=c(H+)=10-7mol/L,然后根据一水合氨的电离平衡常数计算出溶液中氨水的浓度,再计算出氮气反应生成氨气和铵根离子的物质的量,最后计算出转移的电子数;用电惰性极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可,根据电子守恒计算出需要加入的氧化铜.
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体.据此判断.
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
(4)N2在正极发生还原反应生成NH4+,以此书写电极反应式;根据溶液pH=7可知溶液中c(OH-)=c(H+)=10-7mol/L,然后根据一水合氨的电离平衡常数计算出溶液中氨水的浓度,再计算出氮气反应生成氨气和铵根离子的物质的量,最后计算出转移的电子数;用电惰性极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可,根据电子守恒计算出需要加入的氧化铜.
解答:
解:(1)由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,
反应方程式为NH4Cl+2HCl═3H2↑+NCl3.
故答案为:NH4Cl+2HCl═3H2↑+NCl3.
(2)A、ClO2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误.
故选:C.
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点.
故答案为:溶液由蓝色恰好变为无色,且半分钟内不褪色;
③VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=0.1×50×10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.1×50×10-3 mol
所以n(ClO2)=
×0.1×50×10-3 mol.
所以m(ClO2)=
×0.1×50×10-3 mol×67.5g/mol=0.0675g.
故答案为:0.0675g.
(4)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为:N2+6e-+8H+=2NH4+;
已知NH3?H2O在常温下的电离平衡常数为K,N2-H2燃料电池工作一段时间后溶液的pH=7,则溶液中c(OH-)=c(H+)=10-7mol/L,根据电荷守恒可得:c(Cl-)=c(NH4+)=0.1mol/L,氨水的电离平衡常数为:K=
=
,则溶液中氨水浓度为:c(NH3?H2O)=
mol/L,原电池工作中生成铵根离子和氨水总的物质的量为:(0.05mol/L+
mol/L)×1L=(0.05+
)mol,氮气的化合价为0,氨水和铵根离子中氮元素的化合价为-3价,化合价降低了3价,则转移电子的物质的量为:(0.05+
)mol×3=3×(0.05+
)mol;
CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu,溶液变成硫酸溶液;
电解硫酸铜的方程式为:2CuSO4+2H2O
2Cu+O2 ↑+2H2SO4.所以从溶液中析出的物质是氧气和铜,由元素守恒可知,则向溶液中加入氧化铜可恢复至电解前情况.
3克H2的物质的量为1.5mol,失去电子的物质的量为3mol,能量总利用率为80%,电解转移的电子的物质的量为:3mol×80%=2.4mol;
1mol氧气反应得到4mol电子,若转移2.4mol电子,生成氧气的物质的量为:
=0.6mol,需要加入的氧化铜为0.6mol×2=1.2mol,质量为96g,
故答案为:N2+6e-+8H+=2NH4+;3×(0.05+
)mol;CuO;96g.
反应方程式为NH4Cl+2HCl═3H2↑+NCl3.
故答案为:NH4Cl+2HCl═3H2↑+NCl3.
(2)A、ClO2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误.
故选:C.
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点.
故答案为:溶液由蓝色恰好变为无色,且半分钟内不褪色;
③VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=0.1×50×10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.1×50×10-3 mol
所以n(ClO2)=
| 1 |
| 5 |
所以m(ClO2)=
| 1 |
| 5 |
故答案为:0.0675g.
(4)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为:N2+6e-+8H+=2NH4+;
已知NH3?H2O在常温下的电离平衡常数为K,N2-H2燃料电池工作一段时间后溶液的pH=7,则溶液中c(OH-)=c(H+)=10-7mol/L,根据电荷守恒可得:c(Cl-)=c(NH4+)=0.1mol/L,氨水的电离平衡常数为:K=
| c(NH +4)?c(OH -) |
| c(NH3?H2O) |
| 0.1×1×10 -7 |
| c(NH3?H2O) |
| 1×10 -8 |
| K |
| 1×10 -8 |
| K |
| 1×10 -8 |
| K |
| 1×10 -8 |
| K |
| 1×10 -8 |
| K |
CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu,溶液变成硫酸溶液;
电解硫酸铜的方程式为:2CuSO4+2H2O
| ||
3克H2的物质的量为1.5mol,失去电子的物质的量为3mol,能量总利用率为80%,电解转移的电子的物质的量为:3mol×80%=2.4mol;
1mol氧气反应得到4mol电子,若转移2.4mol电子,生成氧气的物质的量为:
| 2.4mol |
| 4 |
故答案为:N2+6e-+8H+=2NH4+;3×(0.05+
| 1×10 -8 |
| K |
点评:本题考查阅读题目获取信息能力、氧化还原反应滴定及应用、离子检验、对工艺流程及装置理解分析和化学电源新型电池的工作原理及计算等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
相关题目
关于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H的有关图象如下:则下列不正确的是( )
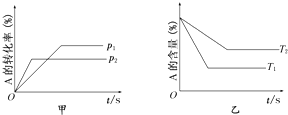

| A、p1<p2 T1>T2 |
| B、减小压强,正逆反应速率都减小,平衡右移 |
| C、△H>0△S>0 |
| D、升高温度,混合气体的平均摩尔质量增大 |
 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题: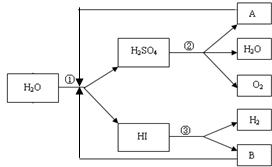 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程: 已知1,2-二溴乙烷的主要物理性质如表:
已知1,2-二溴乙烷的主要物理性质如表: