题目内容
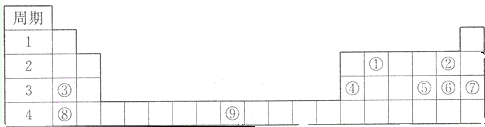
下表为元素周期表的一部分,其中编号代表对应的元素.
请回答下列问题:
(1)写出元素⑦的外围电子排布式 .⑥的离子结构示意图为 .
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中碳原子的杂化轨道的类型是 .
(3)请写出由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式 ,其VSEPR构型为 .
(4)将①和④形成的常见化合物在水中的溶解度较大,可能的原因有 、 、 .
(5)若⑧的元素符号用R表示,R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 .

请回答下列问题:
(1)写出元素⑦的外围电子排布式
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中碳原子的杂化轨道的类型是
(3)请写出由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式
(4)将①和④形成的常见化合物在水中的溶解度较大,可能的原因有
(5)若⑧的元素符号用R表示,R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Cr、⑧为Cu.
(1)根据核外电子排布规律书写Cr原子外围电子排布式;F-离子质子数为9,核外有10个电子,有2个电子层,各层电子数为2、8;
(2)H、C、O形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则H、C、O原子数目之比=
:
:
=2:1:2,该化合物对氢气的相对密度为23,相对分子质量为46,则化合物为HCOOH;
(3)由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式为N2O,计算O原子价层电子对数确定VSEPR构型;
(4)根据氨气与水反应、氢键及相似相溶极性判断;
(5)FeO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,说明生成Fe3+,且有无色气体产生,则生成O2,配平书写离子方程式.
(1)根据核外电子排布规律书写Cr原子外围电子排布式;F-离子质子数为9,核外有10个电子,有2个电子层,各层电子数为2、8;
(2)H、C、O形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则H、C、O原子数目之比=
| 1 |
| 1 |
| 6 |
| 12 |
| 16 |
| 16 |
(3)由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式为N2O,计算O原子价层电子对数确定VSEPR构型;
(4)根据氨气与水反应、氢键及相似相溶极性判断;
(5)FeO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,说明生成Fe3+,且有无色气体产生,则生成O2,配平书写离子方程式.
解答:
解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Cr、⑧为Cu.
(1)Cr原子外围电子排布式为3d54s1;F-离子质子数为9,核外有10个电子,有2个电子层,各层电子数为2、8,离子结构示意图为: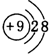 ,
,
故答案为:3d54s1; ;
;
(2)H、C、O形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则H、C、O原子数目之比=
:
:
=2:1:2,该化合物对氢气的相对密度为23,相对分子质量为46,则化合物为HCOOH,分子中C原子成3个σ键,C原子采取sp2杂化,故答案为:sp2;
(3)由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式为N2O,O原子价层电子对数=2+
=2,其VSEPR构型为直线型,故答案为:N2O;直线型;
(4)NH3能与水反应,NH3是极性分子,NH3与水分子之间还可以形成氢键,故氨气极易溶于水,
故答案为:NH3能与水反应;NH3是极性分子;NH3与水分子之间还可以形成氢键
(5)FeO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,说明生成Fe3+,且有无色气体产生,则生成O2,离子方程式为:4FeO42-+20 H+═4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20 H+═4Fe3++3O2↑+10H2O.
(1)Cr原子外围电子排布式为3d54s1;F-离子质子数为9,核外有10个电子,有2个电子层,各层电子数为2、8,离子结构示意图为:
 ,
,故答案为:3d54s1;
 ;
;(2)H、C、O形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则H、C、O原子数目之比=
| 1 |
| 1 |
| 6 |
| 12 |
| 16 |
| 16 |
(3)由④和⑤两种元素形成的与N-3互为等电子体的分子的化学式为N2O,O原子价层电子对数=2+
| 6-3×2 |
| 2 |
(4)NH3能与水反应,NH3是极性分子,NH3与水分子之间还可以形成氢键,故氨气极易溶于水,
故答案为:NH3能与水反应;NH3是极性分子;NH3与水分子之间还可以形成氢键
(5)FeO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,说明生成Fe3+,且有无色气体产生,则生成O2,离子方程式为:4FeO42-+20 H+═4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20 H+═4Fe3++3O2↑+10H2O.
点评:本题是对物质结构的考查,涉及元素周期表、核外电子排布、杂化轨道、分子结构与性质等,难度不大,注意对基础知识掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
一定条件下,在2L密闭容器中进行如下反应:N2+3H2?2NH3,测得2min内N2的物质的量由6mol减少到2mol,则2min内用N2浓度变化表示的该反应的平均反应速率为( )
| A、1 mol/(L?min) |
| B、2mol/(L?min) |
| C、4 mol/(L?min) |
| D、8mol/(L?min) |