题目内容
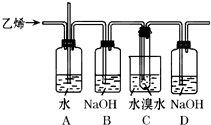 已知1,2-二溴乙烷的主要物理性质如表:
已知1,2-二溴乙烷的主要物理性质如表:| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79°C | 131.4°C | 2.18g/cm3 | 难溶于水,易溶于醇、醚等 |
(1)A、C中都盛有水,这两个装置的作用分别是
(2)B和D装置都盛有NaOH溶液,它们的作用分别是
(3)试写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式
考点:溴乙烷的制取,实验装置综合
专题:实验题
分析:(1)当A中气体压力过大时,水就会从玻璃管上端溢出,起到缓冲作用;
溴易挥发,所以C装置中水的作用是冷却液溴;
(2)以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,A是安全瓶,B是吸收乙烯中混有的SO2、CO2,C是冷却装置,减少产物的挥发,D是吸收逸出的溴蒸气,防止污染空气,据此解答;
(3)以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
溴易挥发,所以C装置中水的作用是冷却液溴;
(2)以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,A是安全瓶,B是吸收乙烯中混有的SO2、CO2,C是冷却装置,减少产物的挥发,D是吸收逸出的溴蒸气,防止污染空气,据此解答;
(3)以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
解答:
解:(1)当A中气体压力过大时,水就会从玻璃管上端溢出,起到缓冲作用;由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,所以C装置中水的作用是冷却液溴,冷却可避免溴的大量挥发,
故答案为:A是缓冲装置;C是冷却装置;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,该装置图中A是安全瓶,B是吸收乙烯中混有的SO2、CO2,C是冷却装置,减少产物的挥发,D是吸收逸出的溴蒸气,防止污染空气,
故答案为:B是吸收乙烯中混有的SO2、CO2;D是吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
CH2=CH2↑+H2O;乙烯分子中含有不饱和键,它和溴水发生加成反应生成无色的1,2-二溴乙烷,即CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH3CH2OH
CH2=CH2↑+H2O,CH2=CH2+Br-Br→CH2Br-CH2Br.
故答案为:A是缓冲装置;C是冷却装置;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,该装置图中A是安全瓶,B是吸收乙烯中混有的SO2、CO2,C是冷却装置,减少产物的挥发,D是吸收逸出的溴蒸气,防止污染空气,
故答案为:B是吸收乙烯中混有的SO2、CO2;D是吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
| 浓H2SO4 |
| 170℃ |
故答案为:CH3CH2OH
| 浓H2SO4 |
| 170℃ |
点评:本题主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质是解答本题的关键,平时须注意积累相关反应知识,题目难度一般.

练习册系列答案
相关题目
下列说法正确的是( )
| A、冰熔化时,分子中H-O键发生断裂 |
| B、HI比HF易分解,是因为HI分子间不存在氢键 |
| C、CO2与SiO2都属于分子晶体 |
| D、熔沸点由高到低的顺序是:金刚石>NaCl>Na |
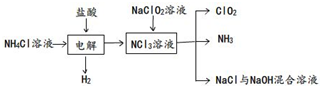
 麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图:
麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图: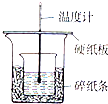 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题: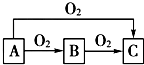 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):