题目内容
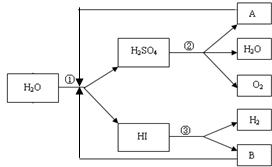 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:(1)实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧的热化学方程式为
(2)整个流程参与循环的物质是
(3)写出反应②的化学反应方程式,并标出电子转移的方向和数目:
(4)新浪科技网报道:美国科学家宣称盐水在无线电作用下可以燃烧,这一发现很可能是21世纪人类最大发现之一,这样可以解决氢能源问题.无线电频率可以降低盐水中某些原子之间的“结合力”,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧.上述中“结合力”应该是
A.离子键 B.共价键 C.范德华力 D.金属键.
考点:热化学方程式,氧化还原反应的电子转移数目计算,不同晶体的结构微粒及微粒间作用力的区别
专题:氧化还原反应专题,化学反应中的能量变化
分析:(1)根据物质的物质的量与反应热成正比,热化学方程式的书写要求书写分析,标注物质聚集状态和对应反应的焓变;
(2)根据流程中的转化来确定能循环使用的物质;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,据此回答;
(4)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
(2)根据流程中的转化来确定能循环使用的物质;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,据此回答;
(4)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答:
解:(1)1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,所以2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=-571.6kJ?mol-1,热化学方程式为2H2(g)+O2(g)=2H2O( l ),△H=-571.6kJ?mol-1,故答案为:2H2(g)+O2(g)=2H2O( l ),△H=-571.6kJ?mol-1;
(2)整个流程参与循环的物质是SO2、I2,故答案为:SO2、I2;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,电子转移的情况如下: ,故答案为:
,故答案为: ;
;
(4)水分子是由H原子和O原子构成的,H原子和O原子之间存在极性共价键,“释放出氢原子”必须破坏水分子内的氢氧键,这是一种共价键,故答案为:B.
(2)整个流程参与循环的物质是SO2、I2,故答案为:SO2、I2;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,电子转移的情况如下:
 ,故答案为:
,故答案为: ;
;(4)水分子是由H原子和O原子构成的,H原子和O原子之间存在极性共价键,“释放出氢原子”必须破坏水分子内的氢氧键,这是一种共价键,故答案为:B.
点评:本题考查了热化学方程式的书写、电子的转移以及离子键和共价键的判断等知识,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
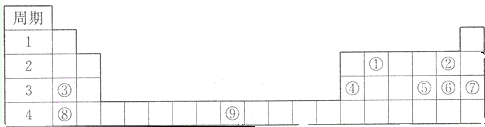
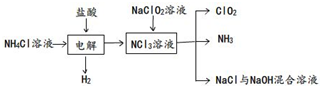
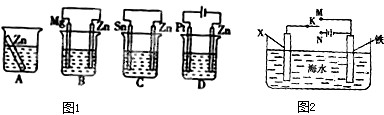
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):