题目内容
10.“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是C.
A.水 B.干冰 C.细沙 D.泡沫灭火器
(2)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O═10HCl+12H3PO4,该反应的氧化剂是HClO3,氧化产物是H3PO4,若有1mol P4参加反应转移电子为20mol.
(3)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是C.
A.NH4NO3→N2+O2+H2O B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O D.NH4NO3→N2+HNO3+H2O
(4)NaCN属于剧毒物质,有多种无害化处理方法.H2O2处理法:NaCN+H2O2-N2↑+X+H2O,推测X的化学式为NaHCO3.
分析 (1)Na、K均与水反应,燃烧产物与二氧化碳反应生成氧气;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素;
(4)根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:C;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:HClO3;H3PO4;20;
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素,
A.NH4NO3→N2+O2+H2O中N元素化合价降低、O元素化合价升高,符合氧化还原反应,故A不选;
B.NH4NO3→NH3+HNO3中各元素化合价不变,符合复分解反应条件,故B不选;
C.NH4NO3→O2+HNO3+H2O中只有O元素化合价升高,所以不符合氧化还原反应,故C选;
D.NH4NO3→N2+HNO3+H2O中N元素有化合价升高的也有化合价降低的,符合氧化还原反应,故D不选;
故答案为:C;
(4)根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案①NaHCO3
②Al2O3
③Al(OH)3
④Al
⑤Na2CO3.
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | 全部 |
| A. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| B. | 常温下PH=9的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 0.1mol/LNaOH溶液中:HCO3-、Na+、K+、Ca2+ | |
| D. | 无色溶液中:H+、Cu2+、Al3+、NO3- |

平衡移动的因素:①升高温度 ②降低温度 ③增大压强 ④减小压强⑤减小生成物B的浓度 ⑥增加反应物的浓度
平衡移动的方向:①正反应方向移动 ②逆反应方向移动 ③不移动
| 序号 | 平衡移动的因素(填序号) | 平衡移动的方向(填序号) |
| A | ||
| B | ||
| C | ||
| D |
| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2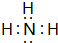 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.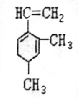 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.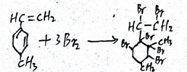 ;
;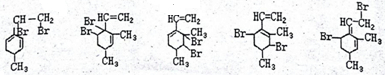 .
.