题目内容
5.世博会中国馆--“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成.①生产玻璃所用的工业设备是玻璃窑发生的主要反应是Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑(用化学方程式表示)②石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是SiO2;有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种塑料,(选填“橡胶”或“纤维”或“塑料”)有机玻璃是由甲基丙烯酸甲酯在一定条件下通过聚合反应合成的有机高分子材料.
分析 ①制备玻璃的原料为:石灰水、纯碱和石英,工业设备为玻璃窑,发生反应:碳酸钠与二氧化硅在高温下生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温下生成硅酸钙和二氧化碳;
②二氧化硅为石英玻璃主要成分;有机玻璃(聚甲基丙烯酸甲酯),据此名称得出此为塑料,塑料为合成的高分子化合物,是由甲基丙烯酸甲酯发生聚合反应生成;
解答 解:①制备玻璃的原料为:石灰水、纯碱和石英,工业设备为玻璃窑,发生反应:碳酸钠与二氧化硅在高温下生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温下生成硅酸钙和二氧化碳,化学方程式:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑;
故答案为:玻璃窑;Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑;
②二氧化硅为石英玻璃主要成分,化学式为SiO2;有机玻璃(聚甲基丙烯酸甲酯),据此名称得出此为塑料,塑料为合成的高分子化合物,是由甲基丙烯酸甲酯发生聚合反应生成;
故答案为:SiO2;塑料;聚合反应.
点评 本题考查生活中常见材料,熟悉常见的硅酸盐材料、高分子材料的组成是解题关键,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
17.(1)工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1.
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
14.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 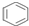 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
16.向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是( )
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
13.将等物质的量的Cl2和SO2气体通入BaCl2溶液中,再滴入紫色石蕊溶液,以下叙述正确的是( )
| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |