题目内容
2.下列溶液中离子一定能大量共存的是( )| A. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| B. | 常温下PH=9的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 0.1mol/LNaOH溶液中:HCO3-、Na+、K+、Ca2+ | |
| D. | 无色溶液中:H+、Cu2+、Al3+、NO3- |
分析 A.与铝产生氢气的溶液,为非氧化性酸或强碱溶液;
B.PH=9的溶液,显碱性;
C.离子之间结合生成沉淀;
D.Cu2+为蓝色.
解答 解:A.与铝产生氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+、Mg2+,故A错误;
B.PH=9的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.HCO3-、OH-、Ca2+结合生成沉淀,不能大量共存,故C错误;
D.Cu2+为蓝色,与无色不符,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是( )
| A. | 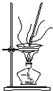 可用于除去碳酸钠固体中含有的少量碳酸氢钠 | |
| B. | 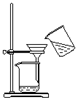 可用于碳酸钙固体和氯化钠溶液的分离 | |
| C. | 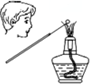 可正确观察钾元素焰色反应 | |
| D. | 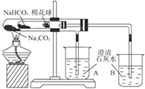 小试管中NaHCO3分解,(B)中澄清石灰水变浑浊,(A)中澄清石灰水没浑浊,说明稳定性Na2CO3>NaHCO3 |
10.下列物质的分类全部正确的是( )
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 盐酸-混合物 胆矾-纯净物 金刚石-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
17.(1)工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1.
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
7.关于Na2CO3与NaHCO3说法正确的是( )
| A. | 等质量的两物质分别与足量盐酸充分反应时,NaHCO3产生CO2气体多 | |
| B. | 可以用澄清石灰水或者氢氧化钠溶液区别 | |
| C. | 等质量的两物质分别与足量的等浓度盐酸反应时,一般是Na2CO3产生CO2气体快 | |
| D. | NaHCO3中Na2CO3混有杂质可以用加热方法除去 |
14.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 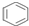 中含碳碳双键数为3NA 中含碳碳双键数为3NA |