题目内容
17.下列有关实验叙述正确的是ADEA 为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验.
B 银氨溶液配制方法:将硝酸银溶液滴到氨水溶液中,至产生的白色沉淀恰好消失.
C 浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀.
D 将l0滴溴乙烷加入 1mL 10%的烧碱溶液中加热片刻后,先加入稀盐酸酸化,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E 只用水就能鉴别苯、硝基苯、乙醇
F 实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃.
分析 A.饱和食盐水反应速率平稳;
B.将稀氨水慢慢滴加到硝酸银溶液中,至产生的沉淀刚好溶解为止;
C.浓溴水滴入苯酚溶液中能产生2,4,6-三溴苯酚的白色沉淀会溶于苯酚中不能观察到沉淀生成;
D.卤代烃在碱溶液中水解生成溴化钠,加入盐酸酸后,滴入硝酸银溶液会观察到淡黄色沉淀生成为溴化银沉淀;
E.只用水就能鉴别的有机物,可根据有机物的水溶性和密度的大小异同鉴别,硝基苯比水重,苯比水轻,乙醇和水混溶;
F.体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时温度要迅速升至170℃.
解答 解:A.电石与水反应非常剧烈,为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行反应,故A正确;
B.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,至产生的沉淀刚好溶解为止,故B错误;
C.苯酚滴入溴水中,苯酚和溴水发生取代发应生成2,4,6-三溴苯酚白色沉淀,故C错误;
D.将l0滴溴乙烷加入 1mL 10%的烧碱溶液中加热片刻后,卤代烃水解生成溴化钠和乙醇,先加入稀盐酸酸化中和氢氧化钠溶液,再滴加2滴2%的硝酸银溶液,生成淡黄色沉淀证明溴离子存在,可以检验水解生成的溴离子,故D正确;
E.乙醇与水混溶,苯和硝基苯不溶于水,但苯的密度比水小,硝基苯的密度比水大,上层为苯,下层为硝基苯,中间为乙醇水溶液可鉴别,故E正确;
F.实验室中用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防止副反应的发生,温度要迅速升至170℃,故F错误,
故答案为:ADE.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机化学中重要的实验设计或实验操作等,侧重分析与实验能力的综合考查,把握物质的性质、实验技能为解答的关键,注意实验的评价性分析,题目难度中等.

练习册系列答案
相关题目
7.分离苯和苯酚的混合物,通常采用的方法是( )
| A. | 振荡混合物,用分液漏斗分离 | |
| B. | 加入NaOH溶液后振荡,用分液漏斗分离;取下层液体通入CO2,待分层后分液 | |
| C. | 加水振荡后用分液漏斗分离 | |
| D. | 加稀盐酸振荡后,用分液漏斗分离 |
8.为了研究外界条件对过氧化钠分解速率的影响,某同学做了以下实验.
(1)①中过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②的目的是探究温度和催化剂对反应速率的影响,为达到使用目的,还需进行的后续操作是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率.(所用试剂限本实验中提供的).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:如图所示.同学们分别从定性和定量角度进行了比较.
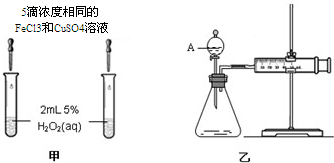
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是:控制阴离子相同,排除阴离子的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未明显见到有气泡产生 |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②的目的是探究温度和催化剂对反应速率的影响,为达到使用目的,还需进行的后续操作是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率.(所用试剂限本实验中提供的).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:如图所示.同学们分别从定性和定量角度进行了比较.

①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是:控制阴离子相同,排除阴离子的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g苯中含有C-C单键数目为0.3NA | |
| B. | 标准状况下,2.24L的CHCl3中含有的C-H键数为0.1NA | |
| C. | 1.4g C2H4和C3H8的混合物中含碳原子数为0.1 NA | |
| D. | 13克溶有乙炔的苯乙烯,其所含的电子数目为7 NA |
12.下列每组物质发生变化所克服的粒子间的相互作用属于同种类型的是( )
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
2. 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
(1)元素A与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).
 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).
9.下列说法错误的是( )
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
6.下列物质的电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |