题目内容
16.将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性,溶液中下列微粒的浓度关系正确的是( )| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
分析 将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性得到等浓度的CH3COONa和CH3COOH的混合溶液,醋酸电离大于醋酸根离子的水解,据此分析.
解答 解:将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性得到等浓度的CH3COONa、CH3COOH和NaCl的混合溶液,醋酸电离大于醋酸根离子的水解,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),
故选D.
点评 本题考查了电解质溶液中离子浓度大小、反应后溶液酸碱性判断和微粒浓度大小比较,主要是醋酸电离和醋酸根离子水解程度的大小分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
6.下列物质的电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列物质属于电解质的是( )
| A. | Cl2 | B. | NH3 | C. | FeSO4 | D. | 蔗糖 |
11.能一次区分CH3COOH、CH3CH2OH、 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
3.环保部门的技术人员常用草酸(H2C2O4)测定酸性工业废水中MnO4-的浓度.某课题组研究发现:少量的摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]可加快溶液紫红色的褪去.为进一步研究有关因素对该反应速率的影响,探究如下:
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
(2)请写出酸性KMnO4溶液与草酸反应生成CO2的离子方程式:2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
10.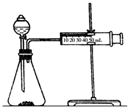 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
(1)该同学的实验目的是比较反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
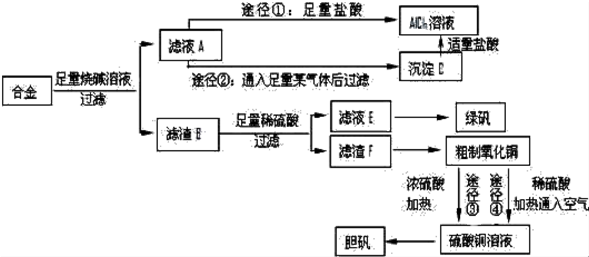
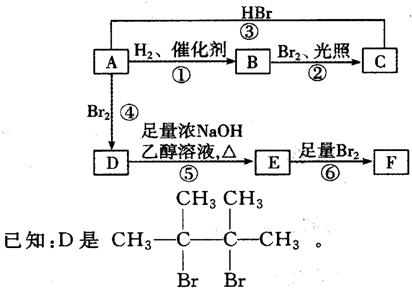
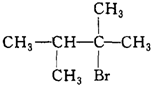 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式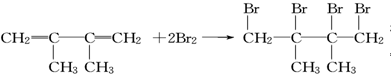 .
.

 .
.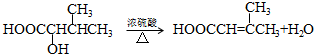 .
. .
. .
.