题目内容
7.T℃时,体积相等的甲、乙、丙、丁4个密闭容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示:| CO2(g) | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| 丁 | amol | amol | amol | amol |
| A. | n(丁)>n(甲)>n(乙)>n(丙) | B. | n(丁)>n(甲)>n(丙)>n(乙) | C. | n(丁)>n(乙)>n(丙)>n(甲) | D. | n(丁)>n(乙)>n(甲)>n(丙) |
分析 由于四个容器体积相同,比较表中的四组数据,以甲的起始量为基础,乙可以看作是在甲的基础上再加amolH2,丙可以看作是在甲的基础上加入amolH2O,丁可以看做在甲的基础上增加amolCO和amolH2O,根据浓度对平衡的影响加以判断.
解答 解:由于三个容器体积相同,比较表中的三组数据,以甲的起始量为基础,乙可以看作是在甲的基础上再加amolH2,则平衡向正反应方向移动,所以CO的物质的量乙大于甲,丙可以看作是在甲的基础上加入amolH2O,则平衡向逆反应方向移动,所以CO的物质的量甲大于丙,丁可以看做在甲的基础上增加amolCO和amolH2O,相当于增大压强,平衡不变,但丁中CO浓度浓度是甲的2倍,所以CO的物质的量n(丁)>n(乙)>n(甲)>n(丙),
故选D.
点评 本题主要考查了浓度对平衡的影响,题目难度不大,解题时注意运用等效平衡的分析方法应用.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
18.下列微粒能将Fe3+还原成Fe2+的是( )
| A. | Cl- | B. | Br- | C. | MnO4- | D. | H2S |
2.下列有关硫元素及其化合物的表示正确的是( )
| A. | 中子数为18的硫离子:${\;}_{16}^{32}$S2- | |
| B. | S2-的结构示意图: | |
| C. | Na2O2的电子式:Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+ | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO32- |
12.在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法中,正确的是( )
| A. | n(Na+)+n(H+)=n(HCO3-)+n(CO32-)+n(OH-) | |
| B. | 通入CO2,平衡向正反应方向移动 | |
| C. | 加入少量的NaOH固体,平衡向逆反应方向移动,溶液pH减小 | |
| D. | 稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
17.下列物质的检验或提纯,其结论或方法正确的是( )
| A. | 某物质中加入BaCl2溶液产生白色沉淀加入稀HNO3后白色沉淀不溶解,说明该溶液中含有Ag+或SO42-中的至少一种 | |
| B. | CO2中混有少量HC1,可用饱和Na2CO3溶液除去 | |
| C. | Cl2中混有少量HCl,可用通入饱和NaCl溶液的方法除去 | |
| D. | N2混有少量NO2,可用水洗法除去 |
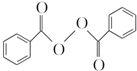 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: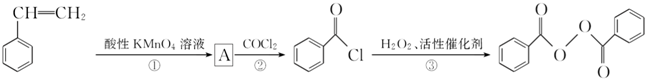
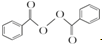 +2H2O→2
+2H2O→2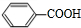 +H2O2;
+H2O2;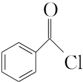 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;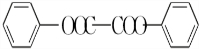 (或
(或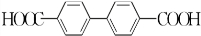 或
或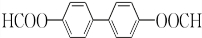 .;
.;
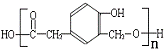 )和某合成鞣剂(
)和某合成鞣剂( 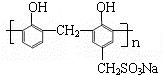 )
)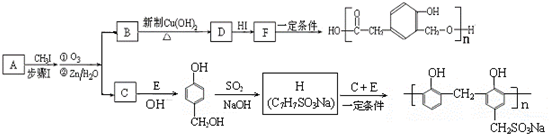
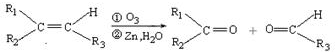 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)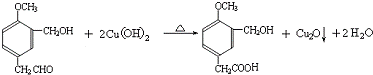 .
. .
.
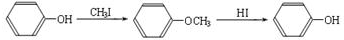
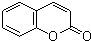 ,写出 X可能的结构简式为
,写出 X可能的结构简式为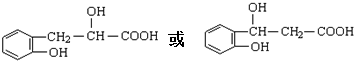 .
.

 .
. .
.