题目内容
12.在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法中,正确的是( )| A. | n(Na+)+n(H+)=n(HCO3-)+n(CO32-)+n(OH-) | |
| B. | 通入CO2,平衡向正反应方向移动 | |
| C. | 加入少量的NaOH固体,平衡向逆反应方向移动,溶液pH减小 | |
| D. | 稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
分析 根据平衡常数与温度的关系及温度、浓度对平衡的影响来分析解答;
A.溶液中存在电荷守恒;
B.通入二氧化碳和氢氧根离子反应促进水解;
C.碳酸根离子水解显碱性,加碱抑制水解;
D.平衡常数随温度变化;
解答 解:A.溶液中存在电荷守恒n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-),故A错误;
B.CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,故B正确;
C.加入NaOH固体,碱性肯定增强,pH增大,故C错误;
D.平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,故D错误;
故选B.
点评 本题考查了水解平衡常数及影响水解平衡的因素,水解平衡常数和化学平衡常数一样是温度的函数,与条件无关.化学平衡移动原理同样适合水解平衡的移动,T题目难度中等.

练习册系列答案
相关题目
2.下列性质的比较中,不正确的是( )
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
3.把500mL含BaCl2和KCl的混合溶液分成两等份,向其中一份中加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;向另一份中加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
20.工业制硫酸中的一步重要反应是2SO2+O2$?_{加热}^{催化剂}$2SO3,这是一个正反应放热的可逆反应.下列说法正确的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 向该体系中充入18O2,一段时间后18O只存在于SO3中 | |
| C. | 生成物的总能量大于反应物的总能量 | |
| D. | 将该反应设计成原电池,放出的热量不变 |
7.T℃时,体积相等的甲、乙、丙、丁4个密闭容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示:
则达到平衡时,CO的物质的量由大到小的顺序是( )
| CO2(g) | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| 丁 | amol | amol | amol | amol |
| A. | n(丁)>n(甲)>n(乙)>n(丙) | B. | n(丁)>n(甲)>n(丙)>n(乙) | C. | n(丁)>n(乙)>n(丙)>n(甲) | D. | n(丁)>n(乙)>n(甲)>n(丙) |
17.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )
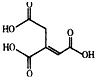

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能发生水解反应和加成反应 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含1mol乌头酸的溶液最多可消耗3molNaOH |
1.鉴别Cl-、Br-、I-三种离子,宜选用的试剂是( )
| A. | 溴水和淀粉溶液 | B. | AgNO3溶液和稀硝酸 | ||
| C. | CCl4溶液 | D. | 氯水和碘化钾淀粉溶液 |
2. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |