题目内容
17.下列物质的检验或提纯,其结论或方法正确的是( )| A. | 某物质中加入BaCl2溶液产生白色沉淀加入稀HNO3后白色沉淀不溶解,说明该溶液中含有Ag+或SO42-中的至少一种 | |
| B. | CO2中混有少量HC1,可用饱和Na2CO3溶液除去 | |
| C. | Cl2中混有少量HCl,可用通入饱和NaCl溶液的方法除去 | |
| D. | N2混有少量NO2,可用水洗法除去 |
分析 A.硝酸具有强氧化性,可氧化SO32-生成SO42-;
B.二者都与饱和Na2CO3溶液反应;
C.氯气不溶于饱和氯化钠溶液;
D.生成NO气体.
解答 解:A.硝酸具有强氧化性,可氧化SO32-生成SO42-,不一定为Ag+或SO42-,故A错误;
B.二者都与饱和Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C.氯气不溶于饱和氯化钠溶液,可用于除杂,故C正确;
D.生成NO气体,应用氢氧化钠溶液,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯以及检验和鉴别,为高考常见题型,注意把握物质的性质的异同以及实验的严密性的评价,难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
7.T℃时,体积相等的甲、乙、丙、丁4个密闭容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示:
则达到平衡时,CO的物质的量由大到小的顺序是( )
| CO2(g) | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| 丁 | amol | amol | amol | amol |
| A. | n(丁)>n(甲)>n(乙)>n(丙) | B. | n(丁)>n(甲)>n(丙)>n(乙) | C. | n(丁)>n(乙)>n(丙)>n(甲) | D. | n(丁)>n(乙)>n(甲)>n(丙) |
5.X、Y、Z 3种元素位于周期表中的同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则3种元素的原子序数的大小顺序是( )
| A. | X>Y>Z | B. | Y>Z>X | C. | X>Z>Y | D. | Z>X>Y |
12.下列关于离子方程式的评价正确的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu作电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2-+2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A. | A | B. | B | C. | C | D. | D |
2. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
9.苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图1装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见如表所示:

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用如图2流程进行精制.
(3)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸;
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(4)操作2中,收集产品时,控制的温度应在199.6℃;
(5)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%;
(6)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用如图2流程进行精制.
(3)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸;
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(4)操作2中,收集产品时,控制的温度应在199.6℃;
(5)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%;
(6)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
6.阿伏加德罗常数用NA表示,下列说法中正确的是( )
| A. | 1 mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 标准状况下,22.4L溴单质所含原子数目为2NA | |
| C. | 密闭容器盛有0.1molN2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 常温常压下,100mL lmol.L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA |
7.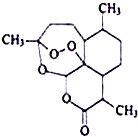 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素易溶于苯,难溶于水 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素的同分异构体不可能有芳香族化合物 |
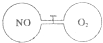 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)